题目内容
10.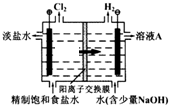 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:(1)溶液A的溶质是NaOH,电解饱和食盐
水的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只
允许Na+(填离子符号,下同)通过,而不允许Cl-、OH-和气体通过.
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2 ④盐酸,这四种试剂的添加顺序为③②①④(填序号).
(4)若将标准状况下6.72L阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5×6.02×1023,产物中得到了两种含氯化合物,写出该反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$5Cl-+ClO3-+3H2O.
分析 (1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH;
(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
解答 解:(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH,其电解离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;在阴极上溶液中生成NaOH,所以A的溶质为NaOH;
故答案为:NaOH;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
故答案为:Na+;Cl-、OH-;
(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,
故答案为:③②①④;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$5Cl-+ClO3-+3H2O;
故答案为:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$5Cl-+ClO3-+3H2O.
点评 本题考查了电解原理的应用、离子方程式的书写,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握电解池中阴阳极上离子的放电顺序以及发生的反应.

| A. | H3O+和OH - | B. | CO和N2 | C. | HNO2和NO2- | D. | CO2和NO2 |
| A. | 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 | |
| B. | 平衡常数越大,表示化学反应速率越大 | |
| C. | 可以用化学平衡常数来定量描述化学反应的限度 | |
| D. | 平衡常数的大小与温度、浓度、压强、催化剂有关 |
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 石蕊 | 酚酞 | 石蕊 |
| 小烧杯中的溶液 | 浓盐酸 | 浓氨水 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | B. |  2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | ||
| C. |  2-甲基-1,丙醇 2-甲基-1,丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |

| 物质 | 熔点/℃ | 沸点/℃ | |
| SiCl4 | -70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
| Si3N4 | 1900 | - | 性质稳定 |
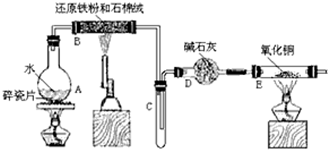
(1)装置B中所加入的试剂名称为碱石灰.
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为药品受热均匀,容易控制温度.
(3)反应开始前先组装好仪器,检查装置的气密性(填操作步骤)后,再加装药品,接下来的操作是③②①(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4 ②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl.
(5)反应过程中,装置E中的现象为有无色液体生成,并产生白烟.
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000mol•L-1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500mol•L-1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为Si3N4+6OH-+3H2O=3SiO32-+4NH3↑.
②产品中Si3N4的质量分数为9.10%(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为NH4F.
| A. | Zn|H2SO4(稀)|C | B. | Cu|CuSO4溶液|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Fe |