题目内容
某种烷烃11克完全燃烧,需标准状况下氧气28升,这种烷烃的化学式是( )A.CH4
B.C2H6
C.C3H8
D.C4H10
【答案】分析:根据1mol烷烃CnH2n+2燃烧时的耗氧量为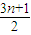 来计算.
来计算.
解答:解:标准状况下28L氧气的物质的量为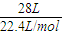 =1.25mol,质量为:1.25mol×32g/mol=40g,设烷烃分子式为CxHy,且y=2x+2,则
=1.25mol,质量为:1.25mol×32g/mol=40g,设烷烃分子式为CxHy,且y=2x+2,则
CxHy+(x+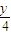 )O2→xCO2+
)O2→xCO2+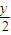 H2O
H2O
12x+y 32(x+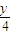 )
)
11g 40g
解得x=3,y=8
所以烷烃分子式为C3H8.
故选C.
点评:本题是一道根据烷烃燃烧的化学方程式来计算的题目,属于基础知识的考查,难度不大.
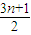 来计算.
来计算.解答:解:标准状况下28L氧气的物质的量为
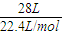 =1.25mol,质量为:1.25mol×32g/mol=40g,设烷烃分子式为CxHy,且y=2x+2,则
=1.25mol,质量为:1.25mol×32g/mol=40g,设烷烃分子式为CxHy,且y=2x+2,则CxHy+(x+
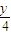 )O2→xCO2+
)O2→xCO2+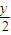 H2O
H2O 12x+y 32(x+
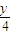 )
)11g 40g
解得x=3,y=8
所以烷烃分子式为C3H8.
故选C.
点评:本题是一道根据烷烃燃烧的化学方程式来计算的题目,属于基础知识的考查,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目