题目内容
9.给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )| A. | 0.1 mol•L-1 HC1$→_{△}^{MnO_{2}}$C12$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| B. | Al3+$\stackrel{过量氨水}{→}$A1O2-$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | A1$\stackrel{Na(OH)(aq)}{→}$NaA1O2(aq) $\stackrel{△}{→}$NaAlO2(s) | |
| D. | MgO(s) $\stackrel{HNO_{3}(aq)}{→}$Mg(NO3)2(aq)$\stackrel{电解}{→}$Mg(s) |
分析 A.二氧化锰能氧化浓盐酸溶液中氯化氢加热反应生成氯气,氯气和石灰水反应生成次氯酸钙、氯化钙和水;
B.铝离子和过量氨水反应生成氢氧化铝沉淀;
C.铝和氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠是强碱弱酸盐,水解生成氢氧化钠和氢氧化铝加热蒸发得到偏铝酸钠;
D.氧化镁溶于吸收生成硝酸镁,电解硝酸镁溶液,生成氢氧化镁沉淀;
解答 解:A.二氧化锰不能和稀盐酸发生氧化还原反应,不能氧化氯离子生成氯气,故A错误;
B.铝离子和过量氨水反应生成氢氧化铝沉淀,氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,反应只能生成氢氧化铝沉淀,故B错误;
C.铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,偏铝酸钠是强碱弱酸盐,水解生成氢氧化钠和氢氧化铝加热蒸发是蒸发水,得到偏铝酸钠,故C正确;
D.氧化镁溶于吸收生成硝酸镁,电解硝酸镁溶液,生成氢氧化镁沉淀,电解硝酸镁溶液不能得到金属镁,故D错误;
故选C.
点评 本题考查了物质性质、物质反应条件下的转化关系、注意知识的积累,掌握基础是解题关键,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.有机物分子 中,最多可有多少个原子共平面( )
中,最多可有多少个原子共平面( )
 中,最多可有多少个原子共平面( )
中,最多可有多少个原子共平面( )| A. | 20 | B. | 19 | C. | 22 | D. | 21 |
17.由2个 、2个
、2个 、1个
、1个 和1个
和1个 构成的有机分子有(不考虑立体异构)( )
构成的有机分子有(不考虑立体异构)( )
 、2个
、2个 、1个
、1个 和1个
和1个 构成的有机分子有(不考虑立体异构)( )
构成的有机分子有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 9种 |
4.硫酸锌可用于制造锌钡白、印染媒染剂等.用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4•7H2O的流程如图.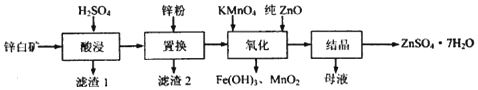
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
(1)“滤渣1”的主要成分为SiO2(填化学式).“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度粉碎锌白矿(或充分搅拌浆料、适当加热等)(填一种).
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).
14.A、B两种元素,A的原子序数为a,如果A和B同在第ⅣA族,当B的周期数大于A的周期数时,B的原子序数不可能为( )
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
4.淀粉碘化钾试纸或溶液是实验室中的常用试剂.某中学化学兴趣小组用淀粉碘化钾溶液进行如下实验:
针对实验中出现的一些反常现象,需要设计实验进行探究:
(1)提出问题:
①实验1、实验2现象不同,猜想原因最有可能是二氧化碳参与氧气与碘离子的氧化反应;要证明该猜想是正确的,可以将用淀粉碘化钾溶液湿润的滤纸置于混有二氧化碳的氧气中,若滤纸变蓝,证明猜想正确.此过程中发生反应的离子方程式是2CO2+O2+4I-=2CO32-+2I2.
②实验3中溶液蓝色褪去的原因可能是
猜想一:氯气将碘单质氧化
猜想二:氯气将淀粉氧化
猜想三:氯气将碘单质和淀粉都氧化
(2)设计探究方案
要证明实验3褪色的原因是猜想一所致,可向褪色后的溶液中滴加少量碘水,若溶液变蓝色,即可证明.
(3)实验反思
查阅相关材料可知,氯所可将单质碘氧化为HIO3,酸性条件下,IO3-可被SO32-、I-还原为碘单质.其工业废水中的阴离子可能含有IO3-、I-中的一种或两种,要证明其中含有何种阴离子,你设计的实验方案是取废水少许于试管中,依次加入淀粉溶液和稀硫酸溶液,弱溶液变蓝色证明同时含有I-、IO3-离子,弱溶液不变蓝,在滴入KI溶液弱溶液变蓝色则证明含、IO3-离子,弱溶液不变蓝证明只含有I-(写出简单的实验步骤、现象和结论).发生反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O.
| 实验编号 | 1 | 2 | 3 |
| 实验步骤 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于空气中,观察现象 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于氧气中,观察现象 | 取少量淀粉碘化钾溶液置于试管中,通往足量的氯气,观察现象 |
| 实验现象 | 试纸缓慢变蓝 | 试纸不变蓝 | 溶液先变蓝后褪色 |
(1)提出问题:
①实验1、实验2现象不同,猜想原因最有可能是二氧化碳参与氧气与碘离子的氧化反应;要证明该猜想是正确的,可以将用淀粉碘化钾溶液湿润的滤纸置于混有二氧化碳的氧气中,若滤纸变蓝,证明猜想正确.此过程中发生反应的离子方程式是2CO2+O2+4I-=2CO32-+2I2.
②实验3中溶液蓝色褪去的原因可能是
猜想一:氯气将碘单质氧化
猜想二:氯气将淀粉氧化
猜想三:氯气将碘单质和淀粉都氧化
(2)设计探究方案
要证明实验3褪色的原因是猜想一所致,可向褪色后的溶液中滴加少量碘水,若溶液变蓝色,即可证明.
(3)实验反思
查阅相关材料可知,氯所可将单质碘氧化为HIO3,酸性条件下,IO3-可被SO32-、I-还原为碘单质.其工业废水中的阴离子可能含有IO3-、I-中的一种或两种,要证明其中含有何种阴离子,你设计的实验方案是取废水少许于试管中,依次加入淀粉溶液和稀硫酸溶液,弱溶液变蓝色证明同时含有I-、IO3-离子,弱溶液不变蓝,在滴入KI溶液弱溶液变蓝色则证明含、IO3-离子,弱溶液不变蓝证明只含有I-(写出简单的实验步骤、现象和结论).发生反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O.
1.有混合气体X,它是由NO、H2、CO2组成,通入足量的Na2O2后,变成混合气体Y,将Y用电火花引燃使其充分反应,只得到质量百分数为70%的HNO3溶液,无其他任何气体,则X中各气体的体积之比为( )
| A. | 2:4:7 | B. | 4:2:7 | C. | 7:4:2 | D. | 3:5:8 |