题目内容
如图图示的有关说法正确的是( )


| A、装置①中负极反应式为H2+2e一=2H+ |
| B、采用装置②精炼铜,则d为粗铜,c为纯铜 |
| C、装置①工作时,外电路电子由a电极流向b电极若 |
| D、若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、燃料电池的负极是燃料失电子;
B、根据电流方向判断电源的正负极,再判断电解池的阴阳极,结合电解精炼的原理分析;
C、原电池中电子从负极流向正极;
D、惰性电极电解稀H2SO4溶液实质是电解水.
B、根据电流方向判断电源的正负极,再判断电解池的阴阳极,结合电解精炼的原理分析;
C、原电池中电子从负极流向正极;
D、惰性电极电解稀H2SO4溶液实质是电解水.
解答:
解:A、燃料电池的负极是燃料失电子,则装置①中负极反应式为H2-2e-═2H+,故A错误;
B、电流从a流出,则a为正极,b为负极,所以c为电解池的阳极,d为阴极,精炼铜时,粗铜作阳极,c为粗铜,d为纯铜,故B错误;
C、原电池中电子从负极流向正极,a极通入氢气为负极,b通入氧气为正极,则电子从a流向b,故C正确;
D、惰性电极电解稀H2SO4溶液实质是电解水,电解后溶液的体积减小,硫酸浓度增大,则PH减小,故D错误.
故选C.
B、电流从a流出,则a为正极,b为负极,所以c为电解池的阳极,d为阴极,精炼铜时,粗铜作阳极,c为粗铜,d为纯铜,故B错误;
C、原电池中电子从负极流向正极,a极通入氢气为负极,b通入氧气为正极,则电子从a流向b,故C正确;
D、惰性电极电解稀H2SO4溶液实质是电解水,电解后溶液的体积减小,硫酸浓度增大,则PH减小,故D错误.
故选C.
点评:本题考查了原电池原理和电解池原理的应用,明确电极的判断方法是关键,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列反应不属于加成反应的是( )
| A、CH2=CH2+H-OH→CH3-CH2-OH | ||
B、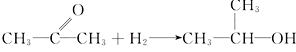 | ||
| C、CH3-CH=CH2+Br2→CH3CHBr→CH2Br | ||
D、N≡N+2H2
|
锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示.下列有关锂空气电池的说法不正确的是( )


| A、随着电极反应的不断进行,正极附近的电解液PH不断升高 |
| B、若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附 |
| C、放电时,当有22.4L O2(标准状况下)被还原时,溶液中有4mol Li+从左槽移动到右槽 |
| D、锂空气电池又称作“锂燃料电池”,其总反应方程为:4Li+O2═2Li2O |
 锌锰干电池中的二氧化锰主要来源于电解法生产.其装置如图所示,电解槽中间用只允许H+离子通过的氢离子交换膜隔开.两侧分别装有MnSO4溶液和稀硫酸,在一定的电压下通电电解.下列说法不正确的是( )
锌锰干电池中的二氧化锰主要来源于电解法生产.其装置如图所示,电解槽中间用只允许H+离子通过的氢离子交换膜隔开.两侧分别装有MnSO4溶液和稀硫酸,在一定的电压下通电电解.下列说法不正确的是( )| A、阳极的电极方程式:Mn2++2H2O-2e?═MnO2+4H+ |
| B、外电路中每通过0.2mol电子,阴极溶液中H+物质的量不变 |
| C、保持电流不变,升高温度,电极反应加快 |
| D、持续电解该溶液,阳极上可能会有氧气生成 |
W.X.Y.Z为短周期元素.在周期表中位置如图所示.有关W、X、Y、Z的叙述不正确的是( )


| A、通常情况下四种元素的单质中X化学性质最稳定 |
| B、四种元素不都能与氢元素形成稳定的化合物 |
| C、Y.Z离子最外层电子数相同 |
| D、四种元素中Z元素最高价氧化物对应的水化物酸性最强 |
下列离子方程式正确的是( )
| A、等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| B、向漂白粉中通入少量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、过量的Fe与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
| D、过量的SO2通入到Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+ |
某课外实验小组设计的下列实验合理的是( )
A、 制备少量氨气 |
B、 吸收HCl |
C、 配制一定浓度硫酸溶液 |
D、 制备并收集少量NO2气体 |