题目内容
11.分子式为C5H10的烯烃共有(要考虑顺反异构体)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 分子式为C5H10的烯烃,说明分子中含有1个C=C双键,根据碳链缩短法书写同分异构体,①先写烷烃同分异构体(烷烃碳骨架)②主链从长到短、支链由整到散、位置由心到边③“C=C”位置移动.考虑顺反异构,C=C双键不饱和的同一C原子上应连接不同的基团或原子具有顺反异构.
解答 解:戊烷的同分异构体有CH3-CH2-CH2-CH2-CH3、 、
、 .
.
若为CH3-CH2-CH2-CH2-CH3,相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3,其中CH3-CH═CH-CH2-CH3有
2种顺反异构,即有3种异构.
若为 ,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2,都不存在顺反异构,即有3种异构.
,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2,都不存在顺反异构,即有3种异构.
若为 ,没有相应烯烃.
,没有相应烯烃.
所以分子式为C5H10的烯烃共有(包括顺反异构)3+3=6种.
故选B.
点评 本题考查同分异构体的书写,难度中等,注意烯烃的同分异构体的书写方法,采取先写碳骨架异构、再移动C=C双键位置.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
2.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,1mol氦气含有原子数为2NA | |
| B. | 0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA | |
| C. | 常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
19.回归、改进、拓展教材实验,是高考化学实验考查的常见形式.
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
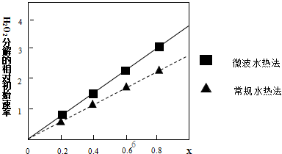
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.
II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
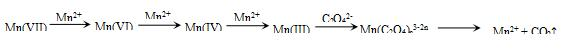
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
仔细阅读分析表中数据,回答问题:
x=25mL,假设2成立(填“1”、“2”或“3”)
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
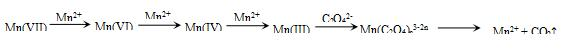
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
x=25mL,假设2成立(填“1”、“2”或“3”)
6.下列实验操作不能达到其对应目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入少量新制的氢氧化铜悬浊液并加热 | 验证淀粉已水解 |
| B | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 在苯酚溶液中加入溴水 | 用FeCl3溶液可检验苯酚是否完全反应 |
| D | 用苯与浓H2SO4和浓HNO3制备硝基苯,将产物倒入NaOH溶液中,静置,分液 | 除去硝基苯中混有浓H2SO4和浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
3.合成人造羊毛: 的单体正确的是( )
的单体正确的是( )
 的单体正确的是( )
的单体正确的是( )| A. |  | B. | CH3-CN | C. | CH2═CHCN | D. | CH2═HCN |
1.下列有关环境问题的说法正确的是( )
| A. | 臭氧的体积分数超过10-4%的空气有利于人体健康 | |
| B. | pH在5.6~7.0之间的雨水通常称为酸雨 | |
| C. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |