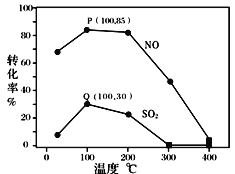
题目内容
【题目】I.现有下列物质①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是________(填序号,下同),能抑制水的电离的是________,水电离的c(OH-)等于溶液中c(OH-)的是________,水电离的c(H+)等于溶液中c(H+)的是________。
(2)②和③溶液中水的电离度相等,进而可推出的结论是:同一温度下,___________时,水的电离度相等。
II.今有①盐酸②醋酸③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等,三种溶液中的c(H+)大小关系为______
(2)若三种溶液的c(H+)相等,三种酸的物质的量浓度大小关系为_____。
【答案】① ②③④ ①② ③④ 酸溶液中的![]() 与碱溶液中的
与碱溶液中的![]() 相等时 ③>①>② ②>①>③
相等时 ③>①>② ②>①>③
【解析】
一定温度下,水存在电离平衡H2O(l)H+(aq)+OH-(aq)△H>0,升高温度或加入能与H+或OH-反应的离子,可促进水的电离,如加入酸或碱,溶液中H+或OH-浓度增大,则抑制水的电离,以此解答该题。
I.(1) ①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液;一定温度下,水存在电离平衡H2O(l)H+(aq)+OH-(aq)△H>0,这些物质与25℃纯水相比,能促进水的电离的是升高温度,因水的电离为吸热反应;
加入酸、碱溶液可抑制水的电离,即②③④抑制水的电离;水电离的![]() 水等于溶液中
水等于溶液中![]() ,可为中性溶液或酸溶液,如纯水、盐酸等,①②符合;水电离的
,可为中性溶液或酸溶液,如纯水、盐酸等,①②符合;水电离的![]() 水等于溶液中
水等于溶液中![]() ,可为中性溶液或碱溶液,如纯水、氢氧化钾、氢氧化钡溶液,①③④符合;
,可为中性溶液或碱溶液,如纯水、氢氧化钾、氢氧化钡溶液,①③④符合;
故答案为:①;②③④;①②;①③④;
(2)纯水中加入酸、碱,可抑制水的电离;从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下酸溶液中的![]() 等于碱溶液中的
等于碱溶液中的![]() ,水的电离程度相等;
,水的电离程度相等;
故答案为:酸溶液中的![]() 与碱溶液中的
与碱溶液中的![]() 相等时;
相等时;
II.(1)今有①盐酸②醋酸③硫酸三种稀溶液,若三种酸的物质的量浓度相等为a,则硫酸中氢离子的浓度为2a,盐酸中氢离子的浓度为a,醋酸不完全电离,氢离子的浓度小于a,则三种溶液中的c(H+)大小关系为③>①>②;
(2)若三种溶液的c(H+)相等,则三种酸的物质的量浓度大小关系与(1)相反:②>①>③。

【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
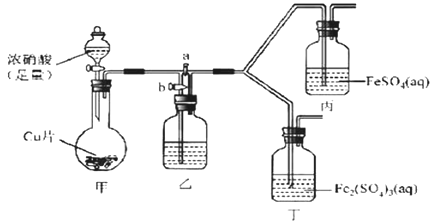
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

【题目】相同温度下体积均为2L的两个恒容容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
SO2 | O2 | SO3 | ||
① | 2 | 1 | 0 | 放热 156.8 kJ |
② | 0.6 | 0.3 | 1.4 | Q(Q>0) |
下列叙述不正确的是
A. 容器①中达到平衡吋,O2的转化率为80%
B. Q=19.6kJ
C. 容器①、②中反应的平衡常数相等,K=80
D. 相同温度下,起始时向容器中充入0.8 mol SO2、0.4 mol O2和3.2 mol SO3,反应达到平衡前v(正)>v(逆)