题目内容
3.下列说法正确的是( )| A. | 盐类水解是吸热反应 | |
| B. | 电解池是将化学能转化为电能的一种装置 | |
| C. | 化学反应中能量的变化都表现为热量的形式 | |
| D. | 水力发电是将化学能转化为电能的过程 |
分析 A.盐类水解是酸碱中和反应的逆过程,属于吸热反应;
B.电解需在外加电源的条件下进行;
C.化学能可转化为热能、光能、电能等;
D.水力发生没有涉及到化学反应.
解答 解:A.盐类水解是酸碱中和反应的逆过程,属于吸热反应,升高温度平衡向吸热方向移动,促进盐类的水解,故A正确;
B.电解池是将电能转化为化学能的一种装置,故B错误;
C.化学能可转化为热能、光能、电能等,不一定都以热能的形式,故C错误;
D.水力发电是将机械能转化为电能的过程,故D错误.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,注意理解常见能量的转化形成,把握物质的性质,题目有利于培养学生良好的科学素养,提高学生的分析能力和双基知识,难度不大.

练习册系列答案
相关题目
13.工业上用菱锰矿[主要成分MnCO3,含FeCO3、SiO2、Cu2(OH)2CO3杂质]为原料制取二氧化锰,其流程示意图如下:

已知ksp(CuS)=1.3×10-36,ksp(MnS)=1.95×10-13,.金属阳离子生成氢氧化物沉淀的pH如表
回答下列问题:
(1)写出滤渣1的主要成分的名称二氧化锰.主要成分MnCO3与稀硫酸反应离子方程式为MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)试剂1最好选用C (填选项字母),其反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
A.次氯酸钠 B.浓盐酸 C.二氧化锰 D.氯水
加入试剂2目的是调节pH值,此时pH应该控制在3.7≤pH≤4.7范围.
(3)写出滤液2中加入MnS后发生反应的离子方程式MnS+Cu2+=Mn2++CuS.该反应的平衡常数为1.5×1023.
(4)用惰性电极电解硫酸锰溶液可以制取二氧化锰,写出电解时阳极的电极反应式Mn2+-2e-+2H2O=4H++MnO2.工业上用硫酸溶解碳酸锰而不用盐酸溶解,其主要优点为氯离子放电生成有毒气体氯气,而SO42-不会.

已知ksp(CuS)=1.3×10-36,ksp(MnS)=1.95×10-13,.金属阳离子生成氢氧化物沉淀的pH如表
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)写出滤渣1的主要成分的名称二氧化锰.主要成分MnCO3与稀硫酸反应离子方程式为MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)试剂1最好选用C (填选项字母),其反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
A.次氯酸钠 B.浓盐酸 C.二氧化锰 D.氯水
加入试剂2目的是调节pH值,此时pH应该控制在3.7≤pH≤4.7范围.
(3)写出滤液2中加入MnS后发生反应的离子方程式MnS+Cu2+=Mn2++CuS.该反应的平衡常数为1.5×1023.
(4)用惰性电极电解硫酸锰溶液可以制取二氧化锰,写出电解时阳极的电极反应式Mn2+-2e-+2H2O=4H++MnO2.工业上用硫酸溶解碳酸锰而不用盐酸溶解,其主要优点为氯离子放电生成有毒气体氯气,而SO42-不会.
14. 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )| A. | 正反应吸热,m+n>x+y | B. | 正反应吸热,m+n<x+y | ||
| C. | 正反应放热,m+n<x+y | D. | 正反应放热,m+n<x+y |
11.溴化钙是一种重要的化工原料,制备CaBr2•2H2O 的主要流程如图:下列说法不正确的是( )


| A. | 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2 | |
| B. | 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结品、洗涤、干燥 | |
| C. | 制得的CaBr2•2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2•2H2O的纯度 | |
| D. | 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2+6H2O |
8.下列有关说法正确的是( )
| A. | 反应CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(g)+HCl(g) 能自发进行,该反应的△H>0 | |
| B. | 多电子原子中,1s、2s、3s电子的能量逐渐增大,2p、3p、4p能级的轨道数依次增多 | |
| C. | 由 +H2$\stackrel{催化剂}{→}$ +H2$\stackrel{催化剂}{→}$ △H=+23kJ•mol-1可知, △H=+23kJ•mol-1可知, 比 比 更稳定 更稳定 | |
| D. | 丙酸甲酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
12.在密闭容器中,反应2A+B?2C达到平衡后,增大压强,平衡向生成C的方向移动.对于A、B、C三种物质的状态判断正确的是( )
| A. | A是气体 | B. | B是气体 | ||
| C. | 如果C是气体,A、B一定是气体 | D. | 如果C是气体,B不一定是气体 |

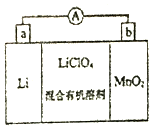 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题: 硫酸工业在国民经济中占有极其重要的地位.
硫酸工业在国民经济中占有极其重要的地位.