题目内容
现有不纯的氯化铜粉末13.5g(内含一种杂质).当与足量的AgNO3溶液反应时,生成29gAgCl沉淀,则粉末中的杂质可能是( )
| A、FeCl3 |
| B、KCl |
| C、ZnCl2 |
| D、BaCl2 |
考点:有关混合物反应的计算
专题:计算题
分析:用假设法求解,13.5gCuCl2与足量盐酸反应生成28.7gAgCl.因为28.7g<29g,说明CuCl2样品中混有的杂质能与硝酸银反应,并且与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素的质量分数高于CuCl2中氯元素的质量分数;
分别计算出CuCl2、FeCl3、BaCl2、KCl、ZnCl2中氯元素的质量分数,然后比较得出答案.
分别计算出CuCl2、FeCl3、BaCl2、KCl、ZnCl2中氯元素的质量分数,然后比较得出答案.
解答:
解:假设13.5g为纯的CuCl2,其物质的量为:n(CuCl2)=
=0.1mol,
根据反应CuCl2+2AgNO3=Cu(NO3)2+2AgCl↓可知,0.1mol氯化铜完全反应生成0.2molAgCl沉淀,
生成沉淀的质量为:143.5g/mol×0.2mol=28.7g<29g,
现为29g,则样品中氯元素的质量分数应大于CuCl2中氯元素的质量分数,
CuCl2、FeCl3、CaCl2、AlCl3、ZnCl2中氯元素的质量分数分别为:
CuCl2:
×100%≈52.6%,
FeCl3:
×100%=65.5%,
KCl:
×100%≈47.7%,
ZnCl2:
×100%≈52.2%,
BaCl2:
×100%≈34.1%,
FeCl3中氯元素的质量分数大于CuCl2中氯元素的质量分数,
故选A.
| 13.5g |
| 135g/mol |
根据反应CuCl2+2AgNO3=Cu(NO3)2+2AgCl↓可知,0.1mol氯化铜完全反应生成0.2molAgCl沉淀,
生成沉淀的质量为:143.5g/mol×0.2mol=28.7g<29g,
现为29g,则样品中氯元素的质量分数应大于CuCl2中氯元素的质量分数,
CuCl2、FeCl3、CaCl2、AlCl3、ZnCl2中氯元素的质量分数分别为:
CuCl2:
| 35.5×2 |
| 64+35.2×2 |
FeCl3:
| 35.5×3 |
| 35.5×3+56 |
KCl:
| 35.5 |
| 35.5+39 |
ZnCl2:
| 35.5×2 |
| 35.5×2+65 |
BaCl2:
| 35.5×2 |
| 35.5×2+137 |
FeCl3中氯元素的质量分数大于CuCl2中氯元素的质量分数,
故选A.
点评:本题考查混合物的计算,题目难度中等,本题可用平均值法和变形法相结合来速解,在解此类题时,可以应用假设法假设所给质量是纯净物的质量,计算出生成沉淀的质量,再找出物质之间的质量关系,用平均值法进行分析解答,要细心分析.

练习册系列答案
相关题目
在城市空气中含有浓度较大的一氧化碳、氮的氧化物等大气污染物,其主要来源是( )
| A、汽车尾气 |
| B、实验室做硝酸实验中排放的废气 |
| C、硫酸工业排放的废气 |
| D、家用液化气不完全燃烧的产生的废气 |
LiAIH4的结构式为 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )| A、释放出H2的厦应都是放热反应 |
| B、LiAIH4中含有离子键、共价键 |
| C、LiAIH4与乙醛作用生成乙醇,LiAIH4作氧化剂 |
| D、LiAIH4在125℃分解,每转移2mol电子放出2.24L的H2 |
下列物质可用溴水鉴别的是( )
| A、汽油、四氯化碳和水 |
| B、氯化钠、溴化钠、碘化钾 |
| C、硝酸银、氢氧化钠和碘化钠 |
| D、HCl、HBr、HI |
碳电极电解R(NO3)x水溶液,在阴极析出金属R的质量为m克,阳极放出标况下560ml氧气.则该金属原子量为( )
| A、11.2mX | ||
B、
| ||
| C、10mx | ||
D、
|
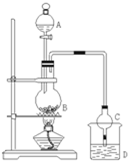 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.



 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.