题目内容
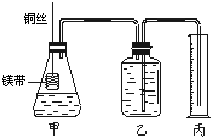
(13分)为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。

(1)实验时,第一步实验操作为:将装有CaCO3干燥管下移与稀硝酸反应生成CO2,该操作作用为 。反应的化学方程式为 。
从装置的设计看,确定E中空气已被赶尽的实验现象是
。
(2)第二步,提起干燥管B, 将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明?
。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
(5)将一定量铜与足量稀硝酸充分反应,可以得到4.48L NO气体(气体体积在标准状况下测定),若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是
(1)除去E烧瓶中空气,防止对NO检验造成干扰; (1分)
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(2分) ;溶液变浑浊(1分)
(2)3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O(2分)
挤压F向E中鼓入空气,E内气体由无色变成红棕色(1分);
(3)应左导管短,右导管长才有利于排尽空气(1分)
(4)吸收多余的尾气,防止污染环境(1分)
(5)3mol/L(2分)
【解析】

 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为