题目内容
向100mL pH=13的NaOH溶液中,滴加0.1mol/L的H2SO4溶液,当所得混合液的pH为12时,加入H2SO4溶液的体积约为( )
分析:所得混合液的pH为12时,则溶液显碱性,混合液中c(OH-)=0.01mol/L,即酸碱混合时,硫酸不足,以此来计算.
解答:解:所得混合液的pH为12时,则溶液显碱性,混合液中c(OH-)=0.01mol/L,
设加入H2SO4溶液的体积约为xmL,
则
=0.01mol/L,
解得x≈43,
故选C.
设加入H2SO4溶液的体积约为xmL,
则
| 0.1L×0.1mol/L-x×0.001L×2×0.1mol/L |
| (100+x)×0.001L |
解得x≈43,
故选C.
点评:本题考查酸碱混合的定量计算,明确pH与浓度的换算及混合后碱过量是解答本题的关键,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08mol | C.0.10mol | D.0.16mol |
(7分)
(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
|
序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
12 |
|
② |
22.00 |
18.00 |
11 |
|
③ |
22.00 |
22.00 |
7 |
x = ____________ ;Ba(OH)2溶液的物质的量浓度为____
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
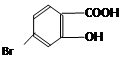 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。