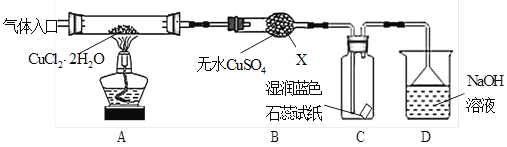
题目内容
【题目】氨基甲酸铵(H2NCOONH4)是常用的氨化剂之一。某研究小组利用反应原理:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH<0制备氨基甲酸铵,其装置如图所示,已知:H2NCOONH4(s)白色固体,易分解、易水解。则下列观点不正确的是( )
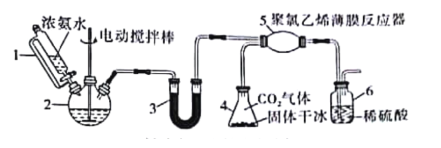
A.仪器1是恒压漏斗,该实验用于防倒吸
B.仪器2和仪器3都可以放置NaOH固体
C.为了完成实验,应在装置5和6之间,依次添加干燥装置和安全瓶
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,应控制旋塞,加大浓氨水的流速
【答案】A
【解析】
A.仪器1是恒压漏斗,其作用为使漏斗内液体顺利流下,A错误;
B.浓氨水和氢氧化钠固体混合可以制氨气,氢氧化钠固体可以干燥氨气,故仪器2和仪器3都可以放置NaOH固体,B正确;
C.防止生成的氨基甲酸铵水解,或者防止氨气过量导致装置6倒吸,应在应在装置5和6之间,依次添加干燥装置和安全瓶,C正确;
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,说明二氧化碳过量,应该加快产生氨气的流速,D正确;
答案选A。

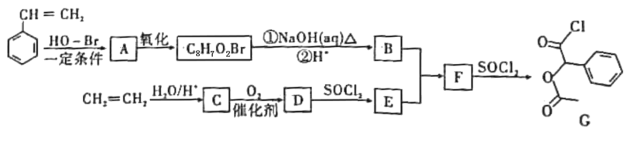
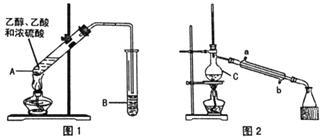
【题目】乙酸乙酯广泛用于药物、燃料、香料等工业,在中学化学实验室里常用如图装置来制备乙酸乙酯。![]() 部分夹持仪器已略去
部分夹持仪器已略去![]()
已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解度 | |
乙醇 | 0.79 | -114.5 | 78.4 | 与水互溶 |
乙酸 | 1.05 | 16.6 | 118.1 | 易溶于水、乙醇 |
乙酸乙酯 | 0.90 | -83.6 | 77.2 | 微溶于水,能溶于乙醇 |
Ⅰ制备粗品(图1)
在A中加入少量碎瓷片,将三种原料依次加入A中,用酒精灯缓慢加热,一段时间后在B中得到乙酸乙酯粗品。
(1)浓硫酸、乙醇、乙酸的加入顺序是___,A中发生反应的化学方程式是___。
(2)A中碎瓷片的作用是___,长导管除了导气外,还具有的作用是___。
(3)B中盛装的液体是___,收集到的乙酸乙酯在___层(填“上”或“下”)。
Ⅱ.制备精品(图2)
将B中的液体分液,对乙酸乙酯粗品进行一系列除杂操作后转移到C中,利用图2装置进一步操作即得到乙酸乙酯精品。
(4)C的名称是___。
(5)实验过程中,冷却水从___口进入(填字母);收集产品时,控制的温度应在___左右。
【题目】二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH___0(填“大于”或“小于”),用O2表示0~2 s内该反应的平均速率为___。
(2)能说明该反应已达到平衡状态的是___。
a.容器内气体颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有_____。
(4)在题述条件下,计算通入2molNO和1molO2的平衡常数K=___。
(5)在题述条件下,若开始通入的是0.2molNO2气体,达到化学平衡时,NO2的转化率为__。
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0
对于反应②,欲提高NO2的转化率,可采取的措施有____。
a.增加原催化剂的表面积 b.降低温度 c.减小投料比[n(NO2)/n(CH4)] d.增大压强