题目内容
7.物质A~J均由短周期元素组成,并有如下图转化关系,A是常见液体,D、F为组成元素相同的无色气体,B、E、G、H是单质,且E是常见光太阳电池中的半导体材料,G、H呈气态,且H呈黄绿色.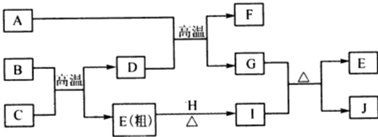
请回答下列问题:
(1)A的电子式为
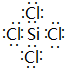 .
. (2)I的化学式为SiCl4.
(3)B与C反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(4)H与氢氧化钠溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 B、E、G、H是单质,E是常见光太阳电池中的半导体材料,则E为Si,H呈黄绿色,应为Cl2,二者反应得到I为SiCl4,B与C反应为硅的制备,可推知B为碳、C为SiO2,D为CO,D与A反应得到F与G,A是常见液体,D、F为组成元素相同的无色气体,故A为H2O、F为CO2、G为H2,G与H(SiCl4)反应得到E(Si)与J,则J为HCl,以此解答该题.
解答 解:B、E、G、H是单质,E是常见光太阳电池中的半导体材料,则E为Si,H呈黄绿色,应为Cl2,二者反应得到I为SiCl4,B与C反应为硅的制备,可推知B为碳、C为SiO2,D为CO,D与A反应得到F与G,A是常见液体,D、F为组成元素相同的无色气体,故A为H2O、F为CO2、G为H2,G与H(SiCl4)反应得到E(Si)与J,则J为HCl,
(1)由上述分析可知,I为SiCl4,其电子式为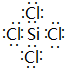 ,故答案为:
,故答案为: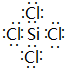 ;
;
(2)由上述分析可知,I的化学式为SiCl4,故答案为:SiCl4;
(3)B与C反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)H与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物推断,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,物质的颜色及用途等时推断突破口,注意掌握中学常见化学工业原理.

练习册系列答案
相关题目
17.恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),并达到化学平衡,根据表中数据回答有关问题
(1)表中a=2.5,e=1.5
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
18.下列操作不合适的是( )
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
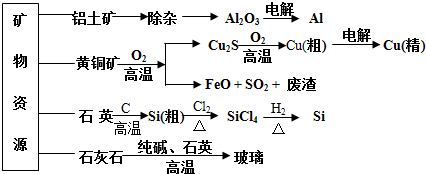

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
19.下列说法正确的是( )
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
16.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.
 .
. +HBr+CH3Br.
+HBr+CH3Br. 等.
等. 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).

 ;
; 、
、 ;
; .
.