题目内容
1.下列说法不正确的是( )| A. | 氢键存在于分子之间,也存在于分子之内 | |
| B. | 对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 冰熔化时只破坏分子间作用力 |
分析 A.邻羟基苯甲醛分子(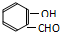 ) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子( 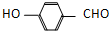 )之间存在氢键;
)之间存在氢键;
B.范德华力与相对分子质量有关;
C.NH3与水分子之间存在氢键;
D.冰熔化时破坏分子间作用力.
解答 解:A.邻羟基苯甲醛分子(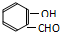 ) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(  )之间存在氢键,所以氢键存在于分子之间,也存在于分子之内,故A正确;
)之间存在氢键,所以氢键存在于分子之间,也存在于分子之内,故A正确;
B.对于组成和结构相似的分子,相对分子质量越大,范德华力越大,即其范德华力随着相对分子质量的增大而增大,故B正确;
C.NH3与水分子之间存在氢键,使氨气易溶于水,所以NH3极易溶于水的原因为NH3是极性分子和氨气与水分子间存在氢键,故C错误;
D.水分子间存在范德华力和氢键,冰熔化时破坏范德华力和氢键,范德华力和氢键属于分子间作用力,故D正确.
故选C.
点评 本题考查了氢键、分子间作用力,题目难度不大,注意把握氢键对物质物理性质的影响,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
17.短周期元素 W、X、Y 和 Z 在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
| W | X | |||
| Y | Z |
| A. | 氢化物沸点:W<Z | |
| B. | 氧化物对应水化物的酸性:Y>W | |
| C. | 简单离子的半径:Y<X | |
| D. | 用电解熔融态 YZ3 的方法制取来单质 Y |
12. 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 简单离子半径:Z>Y>X | |
| B. | 化合物P中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
16.在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)?2HI(g)△H<0.下列说法正确的是( )
| A. | 保持容器容积不变,向其中加入1 mol H2(g),再将平衡时反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),再次平衡时反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次平衡时反应速率一定加快 |
6.检查氯化氢气体中是否混有氯气?可采用的方法是( )
| A. | 用干燥的有色布条检验 | B. | 将气体通入硝酸银溶液 | ||
| C. | 用干燥的蓝色石蕊试纸检验 | D. | 用湿润的碘化钾淀粉试纸检验 |
19.有关如图所示有机化合物的说法不正确的是( )


| A. | 该有机物的分子式为C15H18O4 | |
| B. | 1 mol该化合物最多可以与2 mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |

 ,名称是环己烷.
,名称是环己烷. .
.




 ,则①是E,②是D,③是A(填字母),其中装置E的作用是i观察气体的通入速率ⅱ混合氯气和氮气ⅲ除去氯气中的氯化氢
,则①是E,②是D,③是A(填字母),其中装置E的作用是i观察气体的通入速率ⅱ混合氯气和氮气ⅲ除去氯气中的氯化氢