题目内容
恒温恒压下,amolA和bmolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g)一段时间后达到平衡,生成nmolC.则下列说法正确的是( )A.物质A、B的转化率之比为a:b
B.起始时刻和达到平衡后容器中的压强比为(a+b):(a+b-n)
C.若起始时放入2amolA和2bmolB,则达平衡时生成2nmolC
D.当V正(A)=2V逆(B)时,可确定反应达平衡
【答案】分析:A.若A、B的物质的量之比等于化学计量数之比1:2,则平衡时A、B的转化率相等;
B.恒温恒压下条件下,压强不变;
C.若起始时放入2amolA和2bmolB,A、B的物质的量与原平衡相同为a:b,恒温恒压下,为等效平衡,反应物的转化率与原平衡相同,据此判断;
D.可逆反应到达平衡时,不同物质表示的正、逆速率之比等于化学计量数之比.
解答:解:A.由于a、b的值未知,则A、B的转化率不能确定,故A错误;
B.在恒温、恒压下反应,容器的压强不变,故B错误;
C.原平衡生成nmonC,若起始时放入2amolA和2bmolB,A、B的物质的量与原平衡相同为a:b,恒温恒压下,为等效平衡,反应物的转化率与原平衡相同,则达平衡时生成2nmolC,故C正确;
D.v正(A)=2v逆(B),即v正(A):v逆(B)=2:1,不等于化学计量数之比,反应不处于平衡状态,正反应速率较大,反应向正反应进行,故D错误;
故选C.
点评:本题考查化学平衡的建立,难度中等,注意把握平衡状态的特征以及影响平衡移动的因素,B选项为易错点,容易根据压强之比等于物质的量之比进行解答,注意题给条件.
B.恒温恒压下条件下,压强不变;
C.若起始时放入2amolA和2bmolB,A、B的物质的量与原平衡相同为a:b,恒温恒压下,为等效平衡,反应物的转化率与原平衡相同,据此判断;
D.可逆反应到达平衡时,不同物质表示的正、逆速率之比等于化学计量数之比.
解答:解:A.由于a、b的值未知,则A、B的转化率不能确定,故A错误;
B.在恒温、恒压下反应,容器的压强不变,故B错误;
C.原平衡生成nmonC,若起始时放入2amolA和2bmolB,A、B的物质的量与原平衡相同为a:b,恒温恒压下,为等效平衡,反应物的转化率与原平衡相同,则达平衡时生成2nmolC,故C正确;
D.v正(A)=2v逆(B),即v正(A):v逆(B)=2:1,不等于化学计量数之比,反应不处于平衡状态,正反应速率较大,反应向正反应进行,故D错误;
故选C.
点评:本题考查化学平衡的建立,难度中等,注意把握平衡状态的特征以及影响平衡移动的因素,B选项为易错点,容易根据压强之比等于物质的量之比进行解答,注意题给条件.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
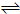 xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.
xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果. 2NH3(g); △H<0
2NH3(g); △H<0
 2NH3(g);△H<0
2NH3(g);△H<0
 2C(g),一段时间后达到平衡,生成nmol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成nmol C。则下列说法中正确的是