题目内容
6.已知:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,有关物质的相关数据如下表:| 化学键 | H2(g) | Br2(g) | HBr(g) |
| 断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
分析 根据盖斯定律计算反应H2(g)+Br2(g)=2HBr(g)的△H,结合反应热等于反应物的总键能减生成物的总键能列方程计算.
解答 解:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,即热化学方程式为H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol反应中,反应热等于反应物的总键能减生成物的总键能,则-72=436+a-2×369,a=230,
故选C.
点评 本题考查反应热的计算,题目难度不大,注意反应热与键能的计算关系以及物质的不同聚集状态的转化.

练习册系列答案
相关题目
16.有人认为元素周期表中位于ⅠA族的氢元素,也可以放在ⅦA族.下列物质支持该观点的是( )
| A. | HF | B. | H3O+ | C. | NaH | D. | H2O2 |
14.归纳整理是科学学习的重要方法之一.在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分).
请根据上表回答下列问题:
(1)硒的熔点范围可能是113℃~450℃
(2)碲的化合价可能有-2,+4,+6
(3)氢硒酸有较强的还原性(填“氧化性”或“还原性”),因此把它放在空气中长期保存容易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓.
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)硒的熔点范围可能是113℃~450℃
(2)碲的化合价可能有-2,+4,+6
(3)氢硒酸有较强的还原性(填“氧化性”或“还原性”),因此把它放在空气中长期保存容易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓.
11.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是( )
| A. | 此电池工作时会发出蓝色火焰 | |
| B. | 燃料电池具有能量转化率高、可持续使用的优点 | |
| C. | 该电池的负极电极反应式为:2H2+4e-═4H+ | |
| D. | 该电池的正极电极反应式为:O2+2H2O+4e-═4OH- |
18.已知酸性强弱顺序为H2CO3>C6H5OH>HCO3-,下列化学方程式正确的是( )
| A. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+Na2CO3 | |
| C. | 2C6H5OH+Na2CO3→2C6H5ONa+CO2↑+H2O | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
15.一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为67.2g,当其缓慢经过无水CaCl2时,CaCl2增重32.4g,则原混合气体中CO2的质量为( )
| A. | 8.4 g | B. | 26.4 g | C. | 30.2 g | D. | 34.8 g |
16.下列各装置能构成原电池的是( )
| A. | 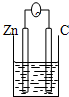 稀硫酸 | B. | 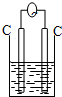 AgNO3(aq) | C. | 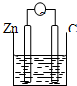 蔗糖 | D. | 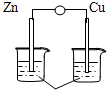 稀硫酸 |
 ,所含化学键类型为共价键.
,所含化学键类型为共价键.