题目内容
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O = 7Cu2S+5FeSO4+12H2SO4下列说法正确的是
| A.Cu2S既是氧化产物,又是还原产物 |
| B.产物中的SO42-有一部分是氧化产物 |
| C.5molFeS2发生反应时,有l0mol电子转移 |
| D.FeS2只做还原剂 |
B
解析试题分析:在反应中CuSO4中是Cu由+2价变成产物Cu2S中的+1价,被还原;FeS2中S为-1价,变成产物Cu2S中的-2价(被还原)和SO42-中的+6价(被氧化)。故Cu2S只是还原产物,A错;产物中的SO42-有一部分是氧化产物,B正确;5molFeS2发生反应时,有3mol的SO42-是被氧化的,共有3×7mol=2lmol电子转移,C错;FeS2既做氧化剂,又做还原剂,D不正确。
考点:氧化还原反应知道氧化剂、还原剂,氧化产物、还原产物,电子转移数目的判断。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
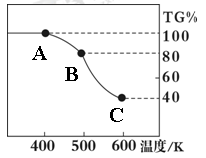
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中不一定含有Fe3+ |
| C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是( )
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
| A.Na[Au(CN)2]不溶于水 |
| B.化合物Na[Au(CN)2]中金元素的化合价为+1 |
| C.金元素在地壳中能以化合态的形式存在 |
| D.在提炼过程中含金元素的物质始终作氧化剂 |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
下列反应中,H2O作还原剂的是
| A.2Na2O2+2H2O =" 4NaOH" + O2↑ | B.2F2+2H2O =" 4HF" + O2↑ |
| C.3NO2 + H2O =" NO" + 2HNO3 | D.3Fe+4H2O(g) 4H2+Fe3O4 4H2+Fe3O4 |