题目内容
 合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.
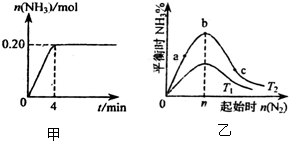
合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.(1)反应过程中测得NH3的物质的量随时间变化情况如图甲所示,请计算:
①从反应开始到平衡这段时间内,
. |
| v |
0.0375mol?L-1?min-1
0.0375mol?L-1?min-1
;反应过程中放出的热量是9.2
9.2
kJ.②若平衡后容器中还有0.1molN2、0.2molH2,则N2的转化率为
50%
50%
,NH3的体积分数φ=40%
40%
.(2)向上述密闭容器中再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,还需加入N2
| z |
| 10 |
| z |
| 10 |
(3)在其他条件不变的情况下,改变N2的起始物质的量n(N2) 对反应的影响如图乙所示(T表示温度),请回答:
①若T1对应温度为500℃,则T2对应温度可能是
D
D
(填字母).A.600℃;B.550℃;C.500℃;D.450℃
②在a、b、c三点所处的平衡状态中,反应物H2转化率最高的是
c
c
点.分析:(1)由图可知,平衡时生成0.2molNH3,v(NH3)=
=0.025mol/(L.min),
①反应速率之比等于化学计量数之比,反应放出的热量与参加反应的物质的量成正比;
②平衡后容器中还有0.1molN2、0.2molH2,氮气的起始量为0.1mol+0.2mol×
=0.2mol,以此计算;
(2)再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,两种状态下的起始量之比相等;
(3)①由图可知,起始量相同时,T2对应氨气的含量高,且该反应为放热反应,降低温度有利于氨气的生成;
②a、b、c三点所处的平衡状态中,温度相同,氮气越多,氢气的转化率越大.
| ||
| 4min |
①反应速率之比等于化学计量数之比,反应放出的热量与参加反应的物质的量成正比;
②平衡后容器中还有0.1molN2、0.2molH2,氮气的起始量为0.1mol+0.2mol×
| 1 |
| 2 |
(2)再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,两种状态下的起始量之比相等;
(3)①由图可知,起始量相同时,T2对应氨气的含量高,且该反应为放热反应,降低温度有利于氨气的生成;
②a、b、c三点所处的平衡状态中,温度相同,氮气越多,氢气的转化率越大.
解答:解:(1)由图可知,平衡时生成0.2molNH3,v(NH3)=
=0.025mol/(L.min),
①反应速率之比等于化学计量数之比,则
(H2)=0.025mol/(L.min)×
=0.0375 mol?L-1?min-1,
反应放出的热量与参加反应的物质的量成正比,放出的热量为92kJ/mol×
=9.2kJ,
故答案为:0.0375 mol?L-1?min-1;9.2;
②平衡后容器中还有0.1molN2、0.2molH2,由平衡时生成0.2molNH3,转化的氮气为0.1mol,氮气的起始量为0.1mol+0.2mol×
=0.2mol,
则N2的转化率为
×100%=50%,NH3的体积分数φ=
×100%=40%,故答案为:50%;40%;
(2)再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,两种状态下的起始量之比相等,
起始的氮气为0.2mol,起始的氢气为0.2mol+0.3mol=0.5mol,比值为2:5,则设还需加氮气xmol建立的平衡等效,则(x+
):
=2:5,解得x=
,
故答案为:
;
(3)①由图可知,起始量相同时,T2对应氨气的含量高,且该反应为放热反应,降低温度有利于氨气的生成,即T2对应稳定温度低于500℃,故答案为:D;
②a、b、c三点所处的平衡状态中,温度相同,氮气越多,氢气的转化率越大,c点氮气最大,则氢气的转化率最大,故答案为:c.
| ||
| 4min |
①反应速率之比等于化学计量数之比,则
. |
| v |
| 3 |
| 2 |
反应放出的热量与参加反应的物质的量成正比,放出的热量为92kJ/mol×
| 0.2mol |
| 2 |
故答案为:0.0375 mol?L-1?min-1;9.2;
②平衡后容器中还有0.1molN2、0.2molH2,由平衡时生成0.2molNH3,转化的氮气为0.1mol,氮气的起始量为0.1mol+0.2mol×
| 1 |
| 2 |
则N2的转化率为
| 0.1mol |
| 0.2mol |
| 0.2mol |
| 0.1mol+0.2mol+0.2mol |
(2)再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,两种状态下的起始量之比相等,
起始的氮气为0.2mol,起始的氢气为0.2mol+0.3mol=0.5mol,比值为2:5,则设还需加氮气xmol建立的平衡等效,则(x+
| z |
| 2 |
| 3z |
| 2 |
| z |
| 10 |
故答案为:
| z |
| 10 |
(3)①由图可知,起始量相同时,T2对应氨气的含量高,且该反应为放热反应,降低温度有利于氨气的生成,即T2对应稳定温度低于500℃,故答案为:D;
②a、b、c三点所处的平衡状态中,温度相同,氮气越多,氢气的转化率越大,c点氮气最大,则氢气的转化率最大,故答案为:c.
点评:本题考查化学平衡的计算,注意分析物质的量和浓度随时间的变化曲线,把握图中线、面的含义及反应速率的计算、转化率的计算等即可解答,侧重学生分析能力及计算能力的考查,(2)中等效平衡为解答的难点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目