题目内容
20.实验室有一包固体,可能含有Na2CO3、NaHCO3和NaOH中的一种或多种.下列根据实验事实得出的结论正确的是( )| A. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中通入的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,加热,若产生的气体能使澄清石灰水变浑浊,说明原固体中一定含有NaHCO3 | |
| D. | 取一定量固体,滴加0.l mol/L盐酸至1L时,溶液呈中性,说明固体中各物质的物质的量总和为0.05 mol |
分析 A.加入CaO,Na2CO3、NaHCO3都可生成沉淀;
B.NaOH可与过量的二氧化碳反应生成NaHCO3;
C.NaHCO3不稳定,加热可分解;
D.滴加0.l mol/L盐酸至1L时,溶液呈中性,说明完全生成NaCl,但不能确定固体的种类和物质的量.
解答 解:A.加入CaO,与水反应生成氢氧化钙,Na2CO3、NaHCO3都可生成沉淀,不能确定,故A错误;
B.NaOH可与过量的二氧化碳反应生成NaHCO3,不一定含有碳酸钠,故B错误
C.NaHCO3不稳定,加热可分解,生成二氧化碳,可说明含有碳酸氢钠,故C正确;
D.滴加0.l mol/L盐酸至1L时,溶液呈中性,说明完全生成NaCl,但不能确定固体的种类和物质的量,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、差量法计算、原子守恒等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合及实验评价性分析,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
10.化学是一门充满神奇色彩的科学.下列说法正确的是( )
| A. | 按分散系中分散质粒子的大小可以把分散系分为溶液、胶体和浊液 | |
| B. | 氧化还原反应的本质是化合价的升降 | |
| C. | 金属的硬度都比较大,不能用刀切 | |
| D. | 氯气常用做自来水的净水剂,原因是氯气无毒,对人体无害 |
11.下列水解化学方程式或水解离子方程式正确的是( )
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | NH4++H2O?NH4OH+H+ | ||
| C. | HCO3-+H2O?CO2↑+H2O | D. | NaCl+H2O?NaOH+HCl |
8.有10g Na2O2、Na2O、Na2CO3、NaOH的混合物与100ml质量分数为2mol•L-1的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
| A. | 11.7 g | B. | 5.85 g | C. | 8 g | D. | 15.5 g |
15.氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品.实验室制取氯苯如图1所示(加热和固定仪器的装置略去).
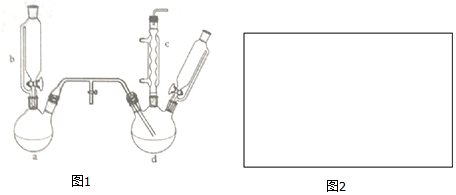
回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为: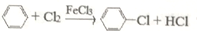 .
.
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
则10t 苯可制得成品氯苯$\frac{10×(1-0.0892)×112.5}{78}$t.(列出计算式即可.氯苯和苯的相对分子质量分别是112,5和78)

回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为:
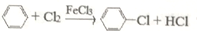 .
.(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
5.下列有关电池的说法不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铁件上镀铜,镀件连接电源的正极,用含Cu2+的盐溶液作电解质溶液 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
14.下列各组物质中能用淀粉碘化钾试纸鉴别的是( )
| A. | 溴水和碘水 | B. | 盐酸和稀硫酸 | C. | 溴水和稀盐酸 | D. | 氯化钾和碘水 |
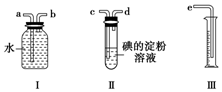 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.