题目内容
2.下列各溶液中微粒的物质的量浓度关系表述正确的是( )| A. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)═c(A-)+c(Cl-) | |
| B. | 在25℃100 mL NH4Cl溶液中:c(Cl-)═c(NH4+)+c(NH3•H2O) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
分析 A、从电荷守恒的角度分析;
B、根据物料守恒分析解答;
C、二元的离子浓度大于一元的离子浓度,强酸弱碱盐溶液呈酸性;
D、物料守恒可知c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-).
解答 解:A、溶液遵循电荷守恒的原则,应有c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故A错误;
B、在25℃100 mL NH4Cl溶液中根据物料守恒可知:c(Cl-)═c(NH4+)+c(NH3•H2O),故B正确;
C、二元的离子浓度大于一元的离子浓度,所以离子浓度大小顺序为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C错误;
D、物料守恒可知c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选B.
点评 本题考查酸碱混合的判断,题目难度不大,注意从物料守恒和电荷守恒的角度分析,把握影响弱电解质电离平衡的因素.

练习册系列答案
相关题目
12.通常情况下,下列物质发生反应,生成的有机物只有一种的是( )
| A. | 甲烷和氯气光照条件下反应 | B. | CH3CH2CHBrCH3发生消去反应 | ||
| C. | 1,3-丁二烯与Br2发生加成反应 | D. | 乙烯和氯化氢发生加成反应 |
13.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | 气态氢化物的稳定性:Y>W>X | |
| B. | X、Y两种元素形成的化合物只有两种 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
17.向密闭容器中充入一定量的N2和H2,发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,要使正反应速率增大,且平衡向正反应方向移动,可采取的措施是( )
| A. | 升温 | B. | 及时分离出氨气 | C. | 加入催化剂 | D. | 增大容器内压强 |
7.某有机物的结构简式如图所示,关于它的叙述不正确的是( )
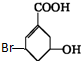

| A. | 该有机物的分子式为C7H9O3Br | |
| B. | 该有机物可使溴水褪色 | |
| C. | 该有机物可发生加成反应、消去反应、取代反应等 | |
| D. | 1mol该有机物与NaOH溶液反应时只能消耗1molNaOH |
14.下列过程中:①电离、②电解、③电镀、④电焊、⑤电化学腐蚀,需要通电才能进行的是( )
| A. | ①② | B. | ②③④ | C. | ③④⑤ | D. | 全部 |
11.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6Cu+SO2↑,关于该反应的说法中,正确的是( )
| A. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| B. | 该反应的氧化剂只有Cu2O | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成19.2gCu,反应中转移1.8mol电子 |
12. 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |