题目内容
若用12 mol•L-1的浓盐酸配制0.10 mol•L-1的稀盐酸480 mL,回答下列问题:
(1)量取浓盐酸的体积为 mL,如果实验室有5mL、10mL、50mL量筒,应选用 mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为 mL 。
(3)配制时所需仪器除了容量瓶和量筒外,还需要的仪器有: 。
(4) 配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是 。
(5)若实验遇下列情况,所配溶液的浓度会有什么影响(填“偏高”,“偏低”或“无影响”)
A.溶解后没有冷却便进行定容________________ |
B.最后定容时,俯视观察液面与容量瓶刻度线________________ |
C.容量瓶内壁附有水珠而未干燥处理_______________ |
D.用量筒量取所需浓盐酸体积时俯视观察 。 |
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7个主族、7个副族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 |
以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 2.2〜2.9 | 2.8 | 22〜28 | 60〜65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
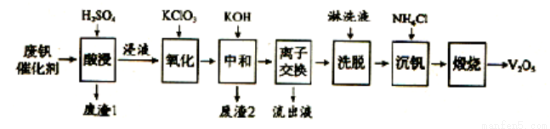
(1) “酸浸”时V2O5转化为VO2+,反应的离子方程式为 ,同时V2O4转成VO2+,“废渣1”的主要成分是 。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为 mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有 。
(4)“离子交换”和“洗脱”可简单表示为:4R0H+ V4 0124-
0124-  R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 。
| A. | 硅是光导纤维的主要成分 | |
| B. | 硅钨酸H4SiW12O40中W的化合价为+6 | |
| C. | 二氧化硅与水反应制得的硅酸溶胶有丁达尔效应 | |
| D. | 硅是非金属元素,合金材料中不可能含有硅 |


 Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+
Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+
 质量分数/%
质量分数/% 〜3.1
〜3.1
 个该原子
个该原子
