题目内容
19.锌空气电池具有蓄电量大、充电循环次数多等优点.下列有关说法错误的是( )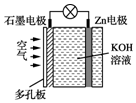
| A. | 电池放电时Zn电极逐渐溶解 | |
| B. | 石墨为正极 | |
| C. | 电子由石墨经导线流向Zn片 | |
| D. | 电池放电时实现了化学能向电能的转化 |
分析 锌为负极,被氧化,石墨为正极,氧气得到电子被还原,碱性条件下,锌可被氧化生成ZnO22-,以此解答该题.
解答 解:A.锌为负极,碱性条件下被氧化生成ZnO22-而溶解,故A正确;
B.石墨为正极,正极上氧气得电子被还原,故B正确;
C.锌为负极,石墨为正极,电子由锌片经导线流向石墨,故C错误;
D.电池放电时为原电池反应,实现了化学能向电能的转化,故D正确.
故选C.
点评 本题考查了化学电源新型电池的构造、工作原理,为高考常见题型和高频考点,题目难度中等,注意掌握原电池工作原理,正确理解题干信息、明确该电池的组成、工作原理是解答本题的关键.

练习册系列答案
相关题目
7.表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素中化学性质最不活泼的是Ar;金属性最强的是K (用元素符号表示).
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(3)A、B、C、G四种元素的简单离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+.(用离子符号回答)
(4)F元素氢化物的化学式是H2O.该氢化物在常温下跟B单质发生反应的离子方程式2K+2H2O═2K++2OH-+H2↑;
(5)H元素的最高价含氧酸与G的最高价含氧酸比较酸性更强的是HClO4 (填化学式)
(6)G元素与H元素两者核电荷数之差是18:写出C元素原子结构示意图 .
.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(3)A、B、C、G四种元素的简单离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+.(用离子符号回答)
(4)F元素氢化物的化学式是H2O.该氢化物在常温下跟B单质发生反应的离子方程式2K+2H2O═2K++2OH-+H2↑;
(5)H元素的最高价含氧酸与G的最高价含氧酸比较酸性更强的是HClO4 (填化学式)
(6)G元素与H元素两者核电荷数之差是18:写出C元素原子结构示意图
 .
.
14.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 医用酒精的浓度通常是95% | |
| B. | “玉兔号”月球车太阳能电池帆板的材料含硅 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | Al2O3和MgO的熔点均很高,可用于制作耐高温材料 |
12.下列仪器:①漏斗、②容量瓶、③蒸馏烧瓶、④天平、⑤分液漏斗、⑥滴定管、⑦燃烧匙,常用于分离物质的仪器是( )
| A. | ①②⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③④⑦ |
13.下列实验操作正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
