题目内容
1919年,科学家第一次实现了人类多年的梦想--人工转变元素.这个核反应如下:
N+
He→
O+
H,下列叙述正确的是( )
7 14 |
4 2 |
17 8 |
1 1 |
A、
 | ||
| B、氦气分子为双原子分子 | ||
C、一个H2
| ||
D、C
 |
考点:质量数与质子数、中子数之间的相互关系
专题:化学用语专题,原子组成与结构专题
分析:A.
O2-离子核内有8个质子,核外有10个电子;
B.稀有气体为单原子分子;
C.根据水的组成计算;
D.二氧化碳中碳氧以双键相结合.
17 8 |
B.稀有气体为单原子分子;
C.根据水的组成计算;
D.二氧化碳中碳氧以双键相结合.
解答:
解:A.
O2-离子核内有8个质子,核外有10个电子,故A正确;
B.稀有气体为单原子分子,故B错误;
C.一个H2
O(水分子)中含电子数为:2+8=10,氢原子无中子,氧原子含中子数为17-8=9,共含9个中子,故C错误;
D.二氧化碳中碳氧以双键相结合,二氧化碳的电子式为: ,故D错误;
,故D错误;
故选A.
17 8 |
B.稀有气体为单原子分子,故B错误;
C.一个H2
17 8 |
D.二氧化碳中碳氧以双键相结合,二氧化碳的电子式为:
 ,故D错误;
,故D错误;故选A.
点评:本题考查原子结构和分子电子式的书写,注意稀有气体为单原子分子和普通氢原子无中子这一特殊性.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2.反应方程式为:2CO+2NO
2CO2+N2,其中NO是( )
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
下列元素属于人体中的微量元素的是( )
| A、C | B、H | C、O | D、Fe |
关于下列图示的说法中不正确的是( )


| A、用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图②所示实验装置排空气法收集H2气体 |
| C、图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、图④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
有关粒子在相应条件下能大量共存的是( )
| A、常温常压下混合气体:H2、F2、NO、O2 |
| B、能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C、c(H+)=1.0 mol?L-1的溶液中:K+、Fe3+、SO42-、I- |
| D、澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |
蒙古牧民喜欢用银器盛放鲜牛奶.现代科学证明,用银器盛放牛奶,确有其科学道理,因为( )
| A、溶入极微量的银离子,可以杀死牛奶中的细菌,防止牛奶变质 |
| B、用银器盛放牛奶,可以补充人体所需的银元素 |
| C、银易导热,牛奶凉得快 |
| D、银的化学性质稳定,坚固耐用 |
下列有关物质结构的表述正确的是( )
A、 钠离子的结构示意图 钠离子的结构示意图 |
| B、二氧化硅的分子式:SiO2 |
| C、硫原子的最外层电子排布式:1s22s22p63s23p4 |
| D、HCN分子的结构式:H-C≡N |
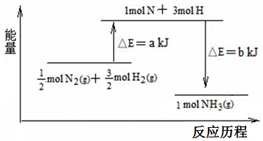 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.