题目内容
氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华.
(1)氯化铝是________(填“离子化合物”或“共价化合物”).
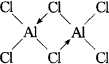
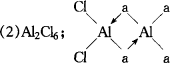
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92 g/L,且已知它的结构中还含有配位键,氯化铝的化学式为________,结构式为________.
(3)如何通过实验来判断氯化铝是离子化合物还是共价化合物?
解析:
|
(1)共价化合物(2)Al2Cl6; (1)从氯化铝的熔点低且易升华的性质可判断其晶体为分子晶体,也就不可能属于离子化合物.我们不能简单地从组成元素为较活泼金属元素和活泼非金属元素考虑,将其认为是离子化合物,应尊重事实.可根据其熔融态能否导电进行判断.切勿用它的水溶液做导电性实验.因为HCl等许多共价化合物在水分子作用能电离,故所得水溶液导电.(2)应根据M=22.4ρ关系式求出蒸气的相对分子质量,与常见的AlCl3相对分子质量比较是否相同,从而确定氯化铝的化学式.要注意配位键的表示方式,“→”是从具有孤对电子的一方指向具有空轨道的原子,在此只可能从Cl→Al,每一个Cl还与Al原子形成一个共价键. ①氯化铝晶体属于分子晶体,氯化铝是共价化合物.②M=22.4ρ=22.4×11.92=267,AlCl3的相对分子质量为133.5,267/133.5=2由此可知氯化铝的蒸气是二聚体,化学式为Al2Cl6,结构式为
(3)因为离子化合物在熔融状态下能电离出自由移动的离子,所以能导电;而共价化合物在熔融状态下不能电离出自由移动的离子,所以不能导电.故将AlCl3加热至熔融状态,测量其导电性,若实验表明它不导电,则说明它为共价化合物. |

 (3)将AlCl3加热至熔融状态,测量其导电性(实验若表明它不导电,则说明它为共价化合物.
(3)将AlCl3加热至熔融状态,测量其导电性(实验若表明它不导电,则说明它为共价化合物.