题目内容
标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,且三者的物质的量之比为8:1:1,则原混合气体中H2的物质的量为( )
A.
| B.(
| ||||||
C.(
| D.
|
方法一:混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),
根据氯元素守恒可知,aLH2和Cl2的混合气体中n(Cl2)=
[n(Cl-)+n(ClO-)+n(ClO-3)]=
n(Na+)=
bmol,所以aLH2和Cl2的混合气体中n(H2)=(
-
)mol
方法二:混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),
由于溶液中Cl-、ClO-、ClO-3三者的物质的量之比为8:1:1,所以溶液中n(Cl-)=
bmol,n(ClO-)=
bmol,n(ClO-3)=
bmol,
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=
b+
bmol×5=
bmol,
溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为
bmol-
bmol=
molb,
即反应后的混合气体中n(HCl)=
bmol,根据氢元素守恒可知,n(H2)=
n(HCl)=
×
molb=0.1bmol,
故选:C.
根据氯元素守恒可知,aLH2和Cl2的混合气体中n(Cl2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 22.4 |
| b |
| 2 |
方法二:混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),
由于溶液中Cl-、ClO-、ClO-3三者的物质的量之比为8:1:1,所以溶液中n(Cl-)=
| 4 |
| 5 |
| 1 |
| 10 |
| 1 |
| 10 |
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=
| 1 |
| 10 |
| 1 |
| 10 |
| 3 |
| 5 |
溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为
| 4 |
| 5 |
| 3 |
| 5 |
| 1 |
| 5 |
即反应后的混合气体中n(HCl)=
| 1 |
| 5 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 5 |
故选:C.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
在标准状况下,将CO2和CO的混合气体(标准状况下,该混合气体平均相对分子质量为32)充满一盛有足量Na2O2的容积为22.4L的密闭容器中,用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是( )
| A、存在0.5mol的CO | B、存在0.25mol的Na2CO3 | C、存在0.125mol的O2 | D、存在0.75mol的Na2CO3 |
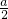 mol
mol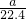 -b)mol
-b)mol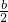 )mol
)mol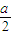 mol
mol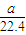 -b)mol
-b)mol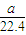 -
-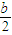 )mol
)mol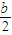 mol
mol