题目内容
2.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“Na2CO3”的分类不正确的是( )| A. | 钠盐 | B. | 碳酸盐 | C. | 碱性氧化物 | D. | 电解质 |
分析 A、阳离子含钠离子的盐为钠盐;
B、阴离子为碳酸根的盐为碳酸盐;
C、能和酸反应生成盐和水的氧化物为碱性氧化物;
D、在水溶液中或熔融状态下能导电的化合物为电解质.
解答 解:A、阳离子含钠离子的盐为钠盐,而Na2CO3的阳离子为钠离子,阴离子为酸根离子,故为钠盐,故A正确;
B、阴离子为碳酸根的盐为碳酸盐,而Na2CO3的阳离子为金属离子,阴离子为碳酸根离子,故为碳酸盐,故B正确;
C、能和酸反应生成盐和水的氧化物为碱性氧化物,而Na2CO3由三种元素构成,故不是氧化物,则不是碱性氧化物,故C错误;
D、在水溶液中或熔融状态下能导电的化合物为电解质,而碳酸钠是离子化合物,在水溶液中和熔融状态下均能导电,故为电解质,故D正确.
故选C.
点评 本题考查了物质的分类,应注意的是碳酸钠根据阴离子属于碳酸盐,根据阳离子属于钠盐,根据在水溶液中或熔融状态下能否导电,还属于电解质,难度不大.

练习册系列答案
相关题目
5.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 将少量浓硝酸逐滴加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯上加热 | 铝箔熔化但并不滴落 | 熔点:Al2O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化亚铁溶液已经变质 |
| D | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 产生大量的白色沉淀 | Al(OH)3难溶于水 |
| A. | A | B. | B | C. | C | D. | D |
2.蒸发海水得到的食盐中,主要含有的可溶性杂质离子除Mg2+、SO42-外,还有( )
| A. | Ca2+ | B. | CO32- | C. | Ba2+ | D. | Al3+ |
9.下列设计的实验方案能达到实验目的是( )
| A. | 制备银氨溶液:向2%的氨水中逐滴加入足量的2%的AgNO3溶液 | |
| B. | 除去MgCl2溶液中少量FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌,充分反应后过滤 | |
| C. | 比较Ag2CO3与AgCl溶度积大小:向浓度均为0.1mol•L-1的Na2CO3和NaCl的混合溶液中滴加0.1mol•L-1 AgNO3溶液,观察现象 | |
| D. | 验证Fe3+与I-的反应有一定限度:向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 |
14.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+)/c(OH?)=1的无色溶液中:Fe3+、NH4+、Cl?、SO42? | |
| B. | 使甲基橙呈黄色的溶液中:Na+、ClO?、SO42?、I? | |
| C. | 0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
11.用分液漏斗可将一组三种二元混合物都分开的是( )
| A. | 酒精和水.酒精和乙醚.溴苯和水 | |
| B. | 溴乙烷和水.乙酸乙酯和水.溴苯和水 | |
| C. | 溴苯和水.油脂和苯.蔗糖和葡萄糖 | |
| D. | 甘油和水.乙醛和水.乙酸和乙醇 |
12.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 盐酸与氢氧化钠反应 | D. | 氧化钙溶于水 |
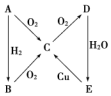 根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式:
根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式: