题目内容
19.某探究小组研究3S2O82-+2Cr3++7H2O$\frac{\underline{\;Ag+\;}}{\;}$Cr2O72-+6SO42-+14H+的反应速率与浓度的关系.反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定.在一定温度下,获得如表实验数据:| 试验编号 | c(S2O82-)/mol•L-1 | c(Cr3+)/mol•L-1 | c(Ag+)/mol•L-1 | 时间/min |
| ① | 0.10 | 10.0 | 5.0 | 10 |
| ② | 0.10 | 10.0 | 2.5 | 20 |
| ③ | 0.20 | 10.0 | 5.0 | 5 |
| ④ | 0.10 | 5.0 | 5.0 | 5 |
| A. | 增大c(Ag+),v(Cr3+)增大 | |
| B. | 实验②的v(Cr3+)为0.25mmol•L-1•min-1 | |
| C. | 增大c(S2O82-),v(Cr3+)增大 | |
| D. | 增大c(Ag+),v(Cr3+)不变 |
分析 影响化学反应速率的因素有浓度、温度、压强以及催化剂等因素,一般情况下在其它条件相同时,反应物的浓度越大,反应速率越快,本题中比较①③数据可以判断出,增大c(S2O82-),v(Cr3+)增大,对比①②组数据,可以判断出增大c(Ag+),v(Cr3+)增大,据此分析解答.
解答 解:A、对比①②组数据,可以判断出增大c(Ag+),v(Cr3+)增大,故A正确;
B、实验②的v(Cr3+)=$\frac{△c}{△t}$=$\frac{5mol/L}{20min}$=0.25mmol•L-1•min-1,故B正确;
C、比较①③数据可以判断出,增大c(S2O82-),v(Cr3+)增大,故C正确;
D、对比①②组数据,可以判断出增大c(Ag+),v(Cr3+)增大,故D错误;
故选D.
点评 本题考查化学反应速率及其影响因素,做题时注意对比表中的数据进行分析,不难得出结论.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-丙基辛烷 的名称为2,4-二乙基-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立体结构)有15种 | |
| D. | 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 |
7.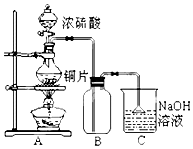 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000mL,取20.00mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是不能,pH>5时,铜离子与碱反应生成沉淀,不能达到滴定终点.
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
14.25℃时,某气态烃与O2混合充入密闭容器中,点燃爆炸后又恢复至25℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空.该烃的化学式可能为( )
| A. | CH4 | B. | C2H4 | C. | C3H6 | D. | C4H10 |
8.下列有关化学用语表示正确的是( )
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: | ||
| C. | 过氧化钠的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
9.下列各组物质的性质或粒子性质的比较正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 还原性:Na+>S2->Br->Cl- | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 水溶液酸性:HF>HCl>HBr>HI |