题目内容
17.现有a、b、c、d四种无色溶液,分别是下列溶液Na2CO3、Na2SO4、NaHSO4、BaCl2中的某一种,为确定各是何种溶液,进行了下面的实验,记录为:①a+d→溶液+气体 ②b+c→溶液+沉淀 ③b+d→溶液+沉淀X
④a+b→溶液Y+沉淀 ⑤沉淀X+溶液Y→溶液+气体
(1)写出溶液a、b、c中溶质的化学式aNaHSO4;bBaCl2;cNa2SO4;
(2)写出反应⑤的离子方程式BaCO3+2H+═Ba2++CO2↑+H2O.
分析 由CO32-、SO42-与Ba2+分别产生Ba2CO3、BaSO4的白色沉淀,而BaCO3可溶于强酸产生气体CO2,而BaSO4不能,结合②③④反应可知,a、c、d都能与b反应产生沉淀,所以b为BaCl2溶液;而由⑤可知沉淀X为BaCO3,溶液Y呈酸性,可知③产生沉淀X,a为Na2CO3,产生溶液Y的④中d为NaHSO4,以此来解答.
解答 解:由CO32-、SO42-与Ba2+分别产生Ba2CO3、BaSO4的白色沉淀,而BaCO3可溶于强酸产生气体CO2,而BaSO4不能,结合②③④反应可知,a、c、d都能与b反应产生沉淀,所以b为BaCl2溶液;而由⑤可知沉淀X为BaCO3,溶液Y呈酸性,可知③产生沉淀X,a为Na2CO3,产生溶液Y的④中d为NaHSO4,最后可知c为Na2SO4,
(1)由上述分析可知,a为NaHSO4,b为BaCl2,c为Na2SO4,故答案为:NaHSO4;BaCl2;Na2SO4;
(2)反应⑤的离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O,故答案为:BaCO3+2H+═Ba2++CO2↑+H2O.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与推断能力的考查,注意b为BaCl2是推断的突破口,题目难度不大.

练习册系列答案
相关题目
12.键线式可以简明扼要的表示碳氢化合物, 种键线式物质是( )
种键线式物质是( )
 种键线式物质是( )
种键线式物质是( )| A. | 丁烯 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
2.氯化钾溶液中混有少量的硫酸铜,若加入一种试剂能除去硫酸铜,该试剂为( )
| A. | NaOH | B. | AgNO3 | C. | BaCl2 | D. | Ba(OH)2 |
9.有机化合物与人类生活水平的提高和人类社会的发展密不可分.下列对有机化合物的认识正确的是( )
| A. | 有机化合物都是共价化合物 | |
| B. | 有机化合物都含有碳、氢元素 | |
| C. | 有机化合物都具有同分异构现象 | |
| D. | 有机物种类多是由碳原子的成键特征决定的 |
7.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(CaO) |
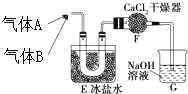 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.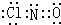 .
.