题目内容
14.(1)甲烷燃料电池,以氢氧化钠溶液做电解质.其负极反应式为:CH4+10OH--8e-=CO32-+7H2O(2)A+、B-、C、D均为10电子微粒,溶液中的A+和B-在加热时相互反应可转化为C和D.其方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O.
分析 (1)甲烷燃料电池中,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,不会在电极上放出二氧化碳;
(2)A+、B-、C、D四种微粒中均有氢原子,且电子总数均为10个,溶液中的A+和B-在加热时相互反应可转化为C和D,则A+、B-分别为NH4+、OH-,铵根离子和氢氧根离子在溶液中加热时生成NH3和H2O,据此分析解答.
解答 解:(1)甲烷燃料电池以NaOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,二氧化碳和氢氧化钠反应得到的是碳酸钠,即CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)A+、B-、C、D四种微粒电子总数均为10个,溶液中的A+和B-在加热时相互反应可转化为C和D,则A+、B-分别为NH4+、OH-,铵根离子和氢氧根离子在溶液中加热时生成NH3和H2O,则方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O.
点评 本题考查燃料电池的负极方程式的书写以及原子结构和元素性质,明确电解质溶液的酸碱性以及10电子微粒是解本题关键,题目难度不大.

练习册系列答案
相关题目
4.下列装置或操作能达到实验目的是( )
| A. | 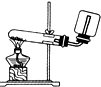 实验室制取并收集NH3 | B. | 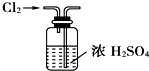 干燥Cl2 | ||
| C. | 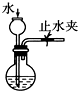 检查装置气密性 | D. |  利用排空气法收集CO2 |
5.X、Y、Z是三种气态物质,在一定温度下其变化符合如图所示.下列说法一定正确的是( )
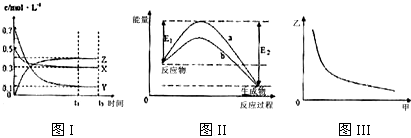

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
2.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体有沉淀产生.则通入的该气体可能是( )
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
9.下列说法不正确的是( )
| A. | 在化学反应进行的过程中放出或吸收的热量称为反应热 | |
| B. | 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 | |
| C. | 氢氧化钡晶体与氯化铵晶体混合是吸热反应 | |
| D. | 化学反应中的能量变化与参加反应的物质的量成正比 |
19.下列各装置图的叙述不正确的是( )


| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |
3.25℃,将Va mL,PH=2的CH3COOH溶液与Vb mL PH=12的NaOH溶液混合,下列说法正确的是( )
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
3.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |