题目内容
5.X、Y、Z是三种气态物质,在一定温度下其变化符合如图所示.下列说法一定正确的是( )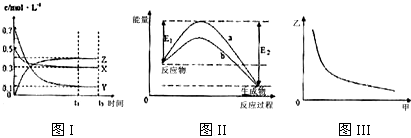
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
分析 图Ⅰ中X、Y的物质的量浓度逐渐减小,应是反应物,Z的物质的量浓度逐渐增大,应是生成物,浓度的变化比值为(0.5-0.3):(0.7-0.1):(0.4-0)=1:3:2,根据浓度的变化之比等于化学计量数之比可知反应方程式应为X(g)+3Y(g)?2Z(g);
由图Ⅱ可知反应物的总能量大于生成物的总能量,反应放热,反应热为△H=-(E2-E1)kJ/mol,且b为催化效果较好;
图Ⅲ纵坐标随横坐标的增大而减小;
A、图Ⅰ中X、Y的物质的量浓度逐渐减小,应是反应物,Z的物质的量浓度逐渐增大,应是生成物,浓度的变化比值为(0.5-0.3):(0.7-0.1):(0.4-0)=1:3:2,根据浓度的变化之比等于化学计量数之比可知反应方程式应为X(g)+3Y(g)?2Z(g),由图Ⅱ可知反应物的总能量大于生成物的总能量,反应放热,反应热为△H=-(E2-E1)kJ/mol;
B、反应是气体体积减小的反应,中等压强平衡正向进行;
C、反应是放热反应,升温平衡逆向进行;
D、催化剂能降低反应的活化能,加快反应速率.
解答 解:A.图Ⅰ中X、Y的物质的量浓度逐渐减小,应是反应物,Z的物质的量浓度逐渐增大,应是生成物,浓度的变化比值为(0.5-0.3):(0.7-0.1):(0.4-0)=1:3:2,根据浓度的变化之比等于化学计量数之比可知反应方程式应为X(g)+3Y(g)?2Z(g),由图Ⅱ可知反应物的总能量大于生成物的总能量,反应放热,反应热为△H=-(E2-E1)kJ/mol,该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ/mol,反应热的单位为kJ/mol,故A错误;
B.压强增大,平衡右移,Z的含量应增大,故B错误;
C.该反应放热,升高温度平衡左移,该反应的平衡常数减小,Y的转化率降低,故C正确;
D.图Ⅱ也可能为加入不同的催化剂,b的催化效果较好,或是曲线b是加入催化剂,曲线a是没有加入催化剂时的能量变化曲线,故D错误.
故选C.
点评 本题考查化学平衡与反应的能量问题,化学平衡移动原理的分析应用,题目较为综合,难度中等,本题注意A和D,题目较为模糊,为易错点.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:2X(g)+2Y(g)?Z(g) |
| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
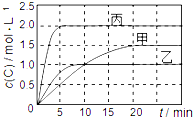 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |
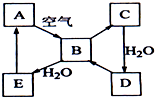 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题: