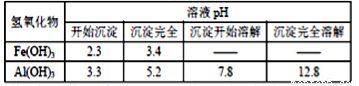
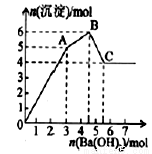
题目内容
14.常温下,下列溶液中离子浓度的关系式不正确的是( )| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 NaHS溶液中:c(H2S)+c(H+)=c(OH-)+c(S2-) | |
| C. | 将pH=2的盐酸和pH=12的氨水等体积混合后的溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液与0.1 mol•L-1 NaOH溶液等体积混合后的溶液中:c(Na+)>c(NH4+)>c(SO42-) |
分析 A.铵根离子部分水解,溶液显示酸性;由于水解程度较小,则c(NH4+)>c(SO42-);
B.根据硫氢化钠溶液中的质子守恒判断;
C.氨水为弱碱,则混合液中氨水过量,溶液呈碱性:c(OH-)>c(H+),结合电荷守恒可知c(NH4+)>c(Cl-);
D.反应后溶质为等浓度的硫酸钠和硫酸铵,根据物料守恒可得:c(Na+)=c(SO42-),铵根离子部分水解,则c(Na+)=c(SO42-)>c(NH4+).
解答 解:A.0.1mol•L-1的(NH4)2SO4溶液中,NH4+部分水解,溶液呈酸性,则:c(H+)>c(OH-),由于水解程度较小,则:c(NH4+)>c(SO42-),溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A正确;
B.根据物料守恒可得:c(Na+)=c(HS-)+c(H2S)+c(S2-),根据电荷守恒可知:c(H+)+c(Na+)=2c(S2-)+c(OH-)+c(HS-),由电荷守恒和物料守恒联立可得:c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确
C.将pH=2的盐酸和pH=12的氨水等体积混合,由于氨水为弱碱,则混合液中氨水过量,溶液呈碱性,则:c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C正确;
D.0.1mol•L-1NH4HSO4溶液与0.1mol•L-1NaOH溶液等体积混合,反应后溶质为等浓度的硫酸钠和硫酸铵,根据物料守恒可得:c(Na+)=c(SO42-),由于铵根离子部分水解,则c(Na+)=c(SO42-)>c(NH4+),故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握判断离子浓度大小常用方法.

| A. | 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液要用冰盐水充分冷却 | |
| B. | 自然界中无游离态的Na、K、Si、Fe,有游离态的S、O | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中不可能形成胶体 | |
| D. | 硅石、玛瑙、硅胶的主要成分是二氧化硅 |

| A. | D极电极反应:O2+4e-+4H+=2H2O | B. | E处通入H2,C处有O2放出 | ||
| C. | 甲池中阴极区只有苯被还原 | D. | 导线中共传导14mol电子 |
| A. | NH3 | B. | H2O | C. | CO2 | D. | H2S |

| A. | 至少6种 | B. | 4种 | C. | 3种 | D. | 2种 |
 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下: 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.