题目内容
15.等质量的两份铜粉分别与足量浓硫酸和浓硝酸充分反应时,消耗的硫酸和硝酸的物质的量分别为a mol和b mol,下列判断正确的是( )| A. | a>b | B. | a<2b | C. | a=b | D. | 2a=b |
分析 Cu与浓硫酸、浓硝酸反应方程式分别为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO3+SO2↑+2H2O、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜的质量相等,则铜的物质的量相等,根据方程式判断a、b的关系.
解答 解:Cu与浓硫酸、浓硝酸反应方程式分别为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO3+SO2↑+2H2O、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜的质量相等,则铜的物质的量相等,假设Cu的物质的量都是1mol,则Cu完全反应需要2mol浓硫酸、4mol浓硝酸,所以2a=b,故选D.
点评 本题考查根据方程式进行计算,正确书写方程式是解本题关键,根据方程式中各个物理量之间的关系式计算即可,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
5.在一定温度下,可逆反应A(g)+3B(g)?2C(g),在密闭容器中反应,达到平衡状态的标志是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)速率V(A):V(B):V(C)=1:3:2;(6)条件一定,混和气体的平均相对分子质量不再变化;(7)A、B、C的分子数目比为1:3:2.
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)速率V(A):V(B):V(C)=1:3:2;(6)条件一定,混和气体的平均相对分子质量不再变化;(7)A、B、C的分子数目比为1:3:2.
| A. | (1)(2)(4)(7) | B. | (2)(3)(5)(6) | C. | (1)(3)(4)(6) | D. | (1)(3)(5)(7) |
6.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 氢氧化镁与盐酸的反应:OH-+H +═H2O | |
| C. | Cl2与NaOH 溶液反应:Cl2+2OH-═Cl-+ClO- | |
| D. | 碳酸钙溶于稀盐酸中CaCO3+2H═Ca2++H2O+CO2↑ |
10.电子构型为[Ar]3d104s2的元素在周期表中属于( )
| A. | 稀有气体p区 | B. | 过渡元素d区 | C. | 副族元素ds区 | D. | 主族元素s区 |
4.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
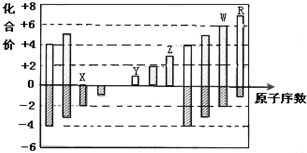

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | 最高价氧化物的水化物的碱性:Y<Z | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
11.2007年3月21日,我国公布了111号元素Rg的中文名称.该元素名称及所在周期是( )
| A. | 钅仑 第七周期 | B. | 镭 第七周期 | C. | 铼 第六周期 | D. | 氡 第六周期 |
8.一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).
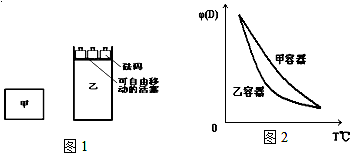
关于两容器中反应的说法正确的是( )

关于两容器中反应的说法正确的是( )
| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍 |
9.将甲烷与氯气按物质的量之比1:3混合,光照条件下发生化学反应后,得到的有机产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |