题目内容
下列可逆反应达平衡后,改变反应条件,其变化趋势正确的是
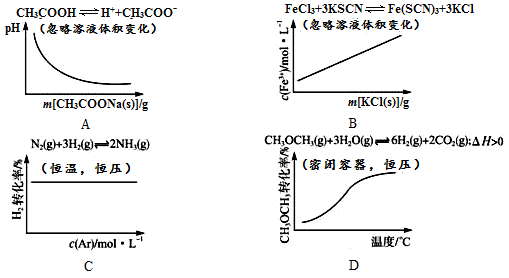

D
试题分析:A、醋酸是弱酸,存在电离平衡CH3COOH
 CH3COO-+H+,加入醋酸钠固体,增大溶液中的CH3COO-浓度,乙醇醋酸的电离,所以溶液的酸性降低,pG增大,A不正确;B、根据离子方程式Fe3++3SCN-=Fe(SCN)3可知,氯离子和钾离子并不参与反应,所以加入氯化钾固体后平衡并不,因此铁离子的浓度不变,B不正确;C、在恒温恒压下充入Ar,则容器的容积增大,物质的浓度降低,所以合成氨反应向逆反应方向移动,反应物的转化率降低,C不正确;D、该反应的正方应是吸热反应,升高温度平衡向正反应方向移动,因此反应物的转化率增大,D正确,答案选D。
CH3COO-+H+,加入醋酸钠固体,增大溶液中的CH3COO-浓度,乙醇醋酸的电离,所以溶液的酸性降低,pG增大,A不正确;B、根据离子方程式Fe3++3SCN-=Fe(SCN)3可知,氯离子和钾离子并不参与反应,所以加入氯化钾固体后平衡并不,因此铁离子的浓度不变,B不正确;C、在恒温恒压下充入Ar,则容器的容积增大,物质的浓度降低,所以合成氨反应向逆反应方向移动,反应物的转化率降低,C不正确;D、该反应的正方应是吸热反应,升高温度平衡向正反应方向移动,因此反应物的转化率增大,D正确,答案选D。
练习册系列答案
相关题目
 CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是 CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则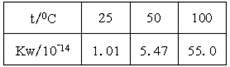

 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是 2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大