题目内容
4.把64.5g的铜锌合金的粉末加入足量的稀硫酸中,得到11.2L H2(标准状况下),试计算:(1)该合金中锌的质量;
(2)该合金中铜和锌的物质的量之比.
分析 (1)铜不与稀硫酸反应,锌与稀硫酸反应为:Zn+2HCl=ZnCl2+H2↑,根据n=$\frac{V}{{V}_{m}}$计算出氢气的物质的量,再结合反应计算出锌的物质的量,根据m=nM计算出锌的质量;
(2)根据总质量计算出合金中铜的质量,再根据n=$\frac{m}{M}$计算出铜的物质的量,最后计算出该合金中铜和锌的物质的量之比.
解答 解:(1)标况下11.2L氢气的物质的量为:n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,铜不与稀硫酸反应,则该氢气为锌与稀硫酸反应生成的,根据反应Zn+2HCl=ZnCl2+H2↑可知,合金中Zn的物质的量为:n(Zn)=n(H2)=0.5mol,
则合金中锌的质量为:65g/mol×0.5mol=32.5g,
答:该合金中锌的质量为32.5g;
(2)合金中铜的质量为:64.5g-32.5g=32g,铜的物质的量为:$\frac{32g}{63.5g/mol}$≈0.5mol,
所以合金中铜和锌的物质的量之比为:0.5mol:0.5mol=1:1,
答:该合金中铜和锌的物质的量之比为1:1.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量与摩尔质量、标况下的气体摩尔体积之间的转化关系.

练习册系列答案
相关题目
15.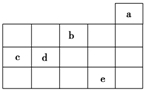 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
下列有关叙述正确的是( )
 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,下列有关叙述正确的是( )
| A. | b元素除0价外,只有一种化合价 | |
| B. | a元素形成的单质最稳定,分子式为a3 | |
| C. | c、d元素的原子半径:c<d | |
| D. | e元素在自然界中主要存在于海水中,被称为“海洋元素” |
12.下列图示与对应的叙述一定正确的是( )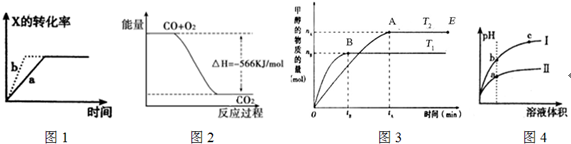

| A. | 图1所示,反应X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2═CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
19.某单烯烃与氢气加成以后的产物是(CH3)2CHCH(CH3)C(CH3)3,该烯烃可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
13.下列物质属于烃的是( )
| A. | C2H5Br | B. | C2H6 | C. | C2H5OH | D. | CH3COOH |
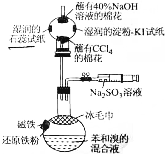 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应. ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;