题目内容
15.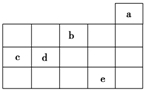 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,下列有关叙述正确的是( )
| A. | b元素除0价外,只有一种化合价 | |
| B. | a元素形成的单质最稳定,分子式为a3 | |
| C. | c、d元素的原子半径:c<d | |
| D. | e元素在自然界中主要存在于海水中,被称为“海洋元素” |
分析 由元素在周期表中位置可知,a为He、b为O、c为Si、d为P、e为Br.
A.氧元素除0价外,还有-1、-2等化合价;
B.稀有气体为单原子分子;
C.同周期随原子序数增大,原子半径减小;
D.Br元素在自然界中主要以溴化物存在于海水中,被称为“海洋元素”.
解答 解:由元素在周期表中位置可知,a为He、b为O、c为Si、d为P、e为Br.
A.氧元素除0价外,还有-1、-2等化合价,故A错误;
B.a为He,原子最外层为稳定结构,化学性质不活泼,为单原子分子,单质分子式为He,故B错误;
C.同周期随原子序数增大,原子半径减小,故原子半径c>d,故C错误;
D.Br元素在自然界中主要以溴化物存在于海水中,被称为“海洋元素”,故D正确,
故选D.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期表的理解掌握,侧重对基础知识的巩固.

练习册系列答案
相关题目
5.五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)请写出元素名称:X碳Y氮Z磷W硫M氯
(2)元素X位于周期表中第二周期ⅣA族;
(3)Y的最高价氧化物的水化物化学式为HNO3;
(4)元素Z可以形成多种单质,其中最常见两种名称分别是白磷、红磷;
(5)W原子的电子式是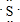 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.
(6)M的单质与水反应的化学方程式是Cl2+H2O═HCl+HClO.
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X碳Y氮Z磷W硫M氯
(2)元素X位于周期表中第二周期ⅣA族;
(3)Y的最高价氧化物的水化物化学式为HNO3;
(4)元素Z可以形成多种单质,其中最常见两种名称分别是白磷、红磷;
(5)W原子的电子式是
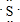 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.(6)M的单质与水反应的化学方程式是Cl2+H2O═HCl+HClO.
3.除去混入NO中的少量NO2应将气体通过下列试剂中的( )
| A. | Na2CO3(aq) | B. | NaHCO3(aq) | C. | H2O | D. | 浓H2SO4 |
10.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 大理石放入稀硝酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铝片插入浓烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
20.“塑料袋--想说爱你不容易!”自1902年10月24日奥地利科学家马克斯•舒施尼发明它以来,也只有短短的一百多年时间.这些花花绿绿、大大小小的塑料袋,不仅破坏城市景观,对环境的危害也是极惊人的.2008年6月1日起,根据国务院要求,所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用.下列说法正确的是( )
| A. | 聚丙烯塑料的结构简式为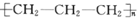 | |
| B. | 聚氯乙烯塑料单体的电子式为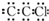 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
7.原子序数依次递增的4种短周期元素可形成简单离子 W2-,X+,Y3+,Z2-,下列说法不正确的是( )
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
5.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 乙烯的结构简式 C2H4 | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型 |
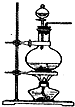 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.