题目内容
某科研小组欲测定一种溶液中某微量的IO3-的浓度,采用“化学放大”的方法.取1L 含IO3-的该溶液和足量的KI溶液混合,加入一定量的H2SO4,使IO3-均转化为I2.用CCl4萃取I2(萃取率为100%),然后再用肼的水溶液将I2反萃取至水相(N2H4+2I2=4I-+N2+4H+),再用过量的Br2氧化,除去剩余的Br2后加入过量的KI,加H2SO4酸化,此时被Br2氧化后所得的IO3-又与I-结合生成I2.用淀粉做指示剂,用Na2S2O3标准溶液(c=0.100mol?L-1)滴定,消耗Na2S2O3 20.06mL.试计算原溶液中IO3-的浓度.
考点:化学方程式的有关计算
专题:计算题
分析:含IO3-的溶液和足量的KI溶液混合,发生反应:5I-+IO3+-+6H+=3I2+3H2O;肼的水溶液将I2反萃取至水相,得到的I-被Br2氧化生成IO3-,除去剩余的Br2后,溶液加入KI,再加入硫酸酸化,又发生反应:5I-+IO3+-+6H+=3I2+3H2O,用Na2S2O3标准溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI,根据方程式先计算与Na2S2O3反应的I2的物质的量,再计算溴氧化得到n(KIO3),根据I元素守恒计算开始氧化得到的n(I2),再根据方程式计算原溶液中n(KIO3),据此解答.
解答:
解:用Na2S2O3标准溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI,与Na2S2O3反应的I2的物质的量为:n(I2)=
×20.06×10-3L×0.100mol/L=1.003×10-3mol,
由5I-+IO3+-+6H+=3I2+3H2O,则溴氧化得到n(KIO3)=
×1.003×10-3mol,
根据I元素守恒可知,开始氧化得到的n(I2)=
×
×1.003×10-3mol,由5I-+IO3+-+6H+=3I2+3H2O,可知原溶液中n(IO3-)=
×
×
×1.003×10-3mol=
×1.003×10-3mol,
故原溶液中c(IO3-)=
×1.003×10-3mol÷1L=5.57×10-5 mol?L-1,
答:原溶液中IO3-的浓度为5.57×10-5 mol?L-1.
| 1 |
| 2 |
由5I-+IO3+-+6H+=3I2+3H2O,则溴氧化得到n(KIO3)=
| 1 |
| 3 |
根据I元素守恒可知,开始氧化得到的n(I2)=
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 18 |
故原溶液中c(IO3-)=
| 1 |
| 18 |
答:原溶液中IO3-的浓度为5.57×10-5 mol?L-1.
点评:本题考查氧化还原反应滴定计算,难度中等,明确反应的反应是关键,为易错题目,注意溴氧化得到n(IO3-)不等于与原溶液中n(IO3-).

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
在KBr和KI混合溶液中,通入足量的氯气,反应后蒸干溶液、灼烧,残留物是( )
| A、KCl |
| B、KCl和KBr |
| C、KCl和KI |
| D、KCl、Br2和I2 |
Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,产物中有NaCl、NaClO和NaClO3.完全反应后,测得溶液中NaClO与NaClO3的物质的量之比为5:1,则溶液中NaCl与NaClO的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、5:1 | D、11:2 |
下列物质中,分别加入少量溴水,振荡后静置,溶液无色的是( )
| A、NaCl溶液 | B、NaOH溶液 |
| C、KI溶液 | D、水 |
下列说法中不正确的是( )
| A、淀粉和纤维素的化学式都是(C6H10O5)n,但由于n不同,淀粉和纤维素并不互为同分异构体 |
| B、鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 |
| C、乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 |
| D、醇CH3CHOHCH3不能在铜或银作催化剂的条件下发生催化氧化反应 |
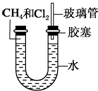 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间. 金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:
金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答: