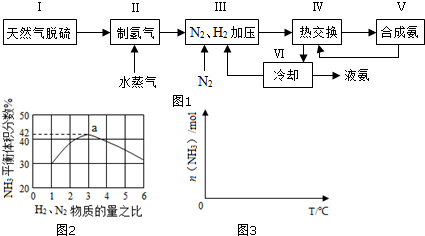
题目内容
13.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的超导材料,关于${\;}_{39}^{89}$Y的说法不正确的是( )| A. | 处于第5周期 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 |
分析 A.先根据构造原理判断元素在周期表中的位置;
B.根据质子数、中子数、质量数之间的关系判断;
C.根据原子的质子数与电子数的关系判断;
D.根据同位素的定义判断.
解答 解:A.依据题干信息可知,Y元素为39号元素,汉字为金字旁元素为金属元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的数字表示电子层数,价电子是4d15S 2,价电子数之和=族序数,所以Y属第五周期第ⅢB族,故A正确;
B.质子数+中子数=质量数,质子数-中子数=质子数-(质量数-质子数)=39-(89-39)=-11.故B错误;
C.原子的核外电子数等于核内质子数,所以核外有39个电子,故C正确;
D.3989Y和3990Y是质子数相同中子数不同的同一元素,所以是不同的两种核素,互为同位素,故D正确;
故选B.
点评 本题考查的是有关质子数、中子数、电子数之间的计算,题目难度中等,明确质量数与中子数、质子数的关系为解答关键,注意掌握同位素的概念及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.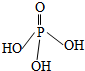 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na5P3O10 | |
| C. | 以磷酸钠为原料通过化合反应也能生成三聚磷酸钠 | |
| D. | 多聚磷酸的结构可表示为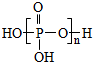 |
1. 利用如图所示装置和对应试剂不能达到相应实验目的是( )
利用如图所示装置和对应试剂不能达到相应实验目的是( )
 利用如图所示装置和对应试剂不能达到相应实验目的是( )
利用如图所示装置和对应试剂不能达到相应实验目的是( ) | 选项 | 实验目的 | M溶液 | 现象 |
| A | 检验乙烷中含有的乙烯 | 酸性高锰酸钾溶液 | 溶液颜色变浅 |
| B | 检验工业合成氨混合气体中的NH3 | 酚酞溶液 | 溶液变红 |
| C | 检验CO2中含有的SO2 | 品红溶液 | 溶液褪色 |
| D | 检验Cl2中含有的HCl | 硝酸银溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
8.实验室常利用Cu(NO3)•3H2O和Na2CO3反应制备碱式碳酸铜2CuCO3•Cu(OH)2,下列做法中,不正确的是( )
| A. | 称取Cu(NO3)•3H2O于烧杯中,加入适量蒸馏水使其溶解得蓝色澄清溶液 | |
| B. | 把Na2CO3白色粉末加入Cu(NO3)•3H2O溶液中,同时加热促进反应 | |
| C. | 搅拌反应体系一段时间后析出大量绿色沉淀 | |
| D. | 将反应混合物过滤得绿色固体产品,用蒸馏水洗三次,烘干既得产品 |
5.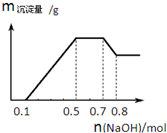 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.1mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
12.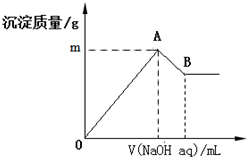 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )| A. | a的取值范围是0<a<$\frac{1}{15}$ | |
| B. | 图中m的取值范围5.2~5.8 | |
| C. | A、B两点横坐标的数值均随x变化而变化 | |
| D. | 若B点横坐标数值为120,则a=0.04 |