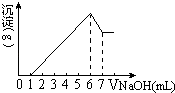题目内容
【题目】铜锌原电池(如图)工作时,回答下列问题: 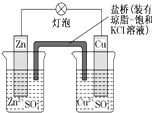
(1)(选填“Zn”或“Cu”)为原电池负极.
(2)在外电路中,电子从(选填“Zn”或“Cu”,下同)极流向极.
(3)正极反应式为
(4)电池反应的离子方程式为
(5)盐桥中的K+移向(选填“ZnSO4”或“CuSO4”)溶液.
【答案】
(1)Zn
(2)Zn;Cu
(3)Cu2++2e﹣═Cu
(4)Zn+Cu2+═Zn2++Cu
(5)CuSO4
【解析】解:(1)活泼性强的金属作负极,活泼性弱的作正极,则Zn为负极;所以答案是:Zn;(2)外电路中电子从负极移向正极,Zn失电子为负极,Cu为正极,则电子从Zn流向铜;所以答案是:Zn;Cu;(3)正极上铜离子得电子,正极上的电极反应式为:Cu2++2e﹣═Cu;所以答案是:Cu2++2e﹣═Cu;(4)电池反应为Zn与铜离子的置换反应,则电池反应的离子方程式为Zn+Cu2+═Zn2++Cu; 所以答案是:Zn+Cu2+═Zn2++Cu;(5)溶液中阳离子向正极移动,所以盐桥中的K+移向溶CuSO4液,所以答案是:CuSO4 .

【题目】Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1 . 其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)O2(aq)△H=nkJmol﹣1 , Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mgL﹣1 , 每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mgL﹣1 , 则0﹣20s内Na2SO3的平均反应速率为molL﹣1s﹣1
(3)为确定贫氧区速率方程v=kca(SO32﹣)cb(O2)中a,b的值(取整数),分析实验数据.
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,则a=
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,则b= ,
(4)两个阶段不同温度的速率常数(k)之比如表.
反应阶段 | 速率方程 |
|
富氧区 | v=kc(SO32﹣)c(O2) | 1.47 |
贫氧区 | v=kca(SO32﹣)cb(O2) | 2.59 |
已知ln ![]() =﹣
=﹣ ![]() (
( ![]() ),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32﹣+O2→SO5﹣
②SO5﹣+SO32﹣→SO52﹣+SO3﹣
③SO32﹣+SO32﹣→SO3﹣+SO32﹣
④SO32﹣+O2→SO5﹣
⑤SO52﹣+SO32﹣→2SO42﹣
富氧区与和贫氧区的决速步分别是、(填序号)