题目内容
【题目】利用硫酸法钛白粉生产中的副产物(主要成分是绿矾、少量TiO2及重金属离子)制备高品质氧化铁红的工艺过程如图1: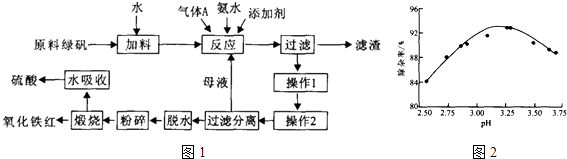
(1)原料绿矾需要加入铁粉进行预处理,其目的为(用离子方程式表示).
(2)利用氨水中和反应可以促进重金属离子水解,以便沉淀出去,如图为pH与除杂率的关系.气体A为(填化学式),调节pH适宜范围为 .
(3)操作1和操作2分别为
(4)绿矾通过脱水、锻烧等工序转化为氧化铁红.反应为:FeSO47H2O ![]() FeSO4H2O+6H2O↑:
FeSO4H2O+6H2O↑:
(5)该过程中可循环使用的物质为(填化学式).
(6)若生产1t钦白粉会产生3t含量为96.5%的绿矾原料,生产中损失5%,则高品质氧化铁红的产量为 t
(7)TiO2可用于制备海绵钛:
①已知:
(i)TiO2(g)+2C12(g)═TiC14(1)+O2(g)△H=+141kJmol﹣1
(ii)TiO2(g)+C(s)+2C12(g)═TiC14(1)+CO2(g)△H=﹣218kJmol﹣1
工业上采用(ii)制备TiC14 , 不能采用(i)的原因是 . 02Mg在高温下还原TiC14制备海绵钦的化学方程式 .
【答案】
(1)Fe+2Fe3+=3Fe2+
(2)N2;3.2﹣4.4
(3)加热浓缩、冷却结晶
(4)4FeSO4?H2O+O2 ![]() 2Fe2O3+4SO3↑+4H2O↑
2Fe2O3+4SO3↑+4H2O↑
(5)FeSO4
(6)0.791
(7)反应属于焓增、熵减的反应,标准状态下任何温度都难以自发反应;TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
【解析】解:原料绿矾中(主要成分是绿矾、少量TiO2及重金属离子),加水溶解再用氨水调节PH值,促进重金属离子水解,以便沉淀出去,除去杂质,过滤后得硫酸亚铁溶液,滤液加热浓缩、冷却结晶,过滤得硫酸亚铁晶体,滤液可循环利用,硫酸亚铁晶体煅烧得氧化铁、三氧化硫,(1)原料绿矾中亚铁离子容易被氧化成铁离子,需要加入铁粉进行预处理,反应的离子方程式为Fe+2Fe3+=3Fe2+ ,
所以答案是:Fe+2Fe3+=3Fe2+;(2)空气中的氧气能氧化硫酸亚铁溶液中的亚铁离子,所以要用氮气隔绝空气,所以气体A为N2 , 根据图中pH与除杂率的关系,可知PH值为3.2﹣4.4之间除杂率最高,所以调节pH适宜范围为,
所以答案是:N2;3.2﹣4.4;(3)从硫酸亚铁溶液中获得硫酸亚铁晶体,可以用加热浓缩、冷却结晶方法获得晶体,
所以答案是:加热浓缩、冷却结晶;(4)绿矾通过脱水、锻烧等工序转化为氧化铁红的过程中FeSO47H2O生成FeSO4H2O,FeSO4H2O再被空气中氧化成氧化铁,反应的化学方程式为4FeSO4H2O+O2 ![]() 2Fe2O3+4SO3↑+4H2O↑,
2Fe2O3+4SO3↑+4H2O↑,
所以答案是:4FeSO4H2O+O2 ![]() 2Fe2O3+4SO3↑+4H2O↑;(5)根据流程分析可知循环的物质为 FeSO4 ,
2Fe2O3+4SO3↑+4H2O↑;(5)根据流程分析可知循环的物质为 FeSO4 ,
所以答案是:FeSO4;(6)3t含量为96.5%的绿矾原料中FeSO47H2O的质量为2895kg,所以含铁元素的质量为2895kg× ![]() ×100%=583.2kg,根据铁元素守恒可知氧化铁的质量为
×100%=583.2kg,根据铁元素守恒可知氧化铁的质量为 ![]() ×583.2×(1﹣5%)kg=0.791t,
×583.2×(1﹣5%)kg=0.791t,
所以答案是:0.791;(7)根据反应 (i)TiO2(g)+2C12(g)═TiC14(1)+O2(g)△H=+141kJmol﹣1 , (ii)TiO2(g)+C(s)+2C12(g)═TiC14(1)+CO2(g)△H=﹣218kJmol﹣1可知,(i)反应是吸热、熵减反应,(ii)是放热、熵增反应,所以采用(ii)制备TiC14 , 不能采用(i)的原因是反应(i)属于焓增、熵减的反应,标准状态下任何温度都难以自发反应,Mg在高温下还原TiC14 , 生成氯化镁和钛,反应的化学方程式为TiCl4+2Mg ![]() Ti+2MgCl2 ,
Ti+2MgCl2 ,
所以答案是:反应属于焓增、熵减的反应,标准状态下任何温度都难以自发反应;TiCl4+2Mg ![]() Ti+2MgCl2 .
Ti+2MgCl2 .

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案