题目内容
4.下列实验现象所对应的离子方程式不正确的是( )| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 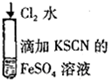 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
| C |  | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性溶液中碘离子被氧化生成碘;
B.亚铁离子被氯气氧化生成铁离子,铁离子转化为络离子;
C.氯气与NaOH反应生成氯化钠、次氯酸钠和水;
D.反应生成硫酸钡和水,不符合离子的配比.
解答 解:A.酸性溶液中碘离子被氧化生成碘,离子反应为4H++4I-+O2=2I2+2H2O,故A正确;
B.亚铁离子被氯气氧化生成铁离子,铁离子转化为络离子,相关离子反应为2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3,故B正确;
C.氯气与NaOH反应生成氯化钠、次氯酸钠和水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.反应生成硫酸钡和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性 | |
| B. | 限制大排量汽车,也是防止酸雨的重要途径 | |
| C. | 镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 | |
| D. | 乙醇可以发生的反应类型有:取代反应、消去反应、加成反应 |
12.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 | |
| B. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 | |
| C. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| D. | 鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯 |
19.某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )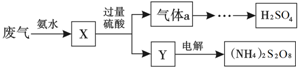

| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
9.下列实验操作能达到目的是( )
| A. | 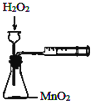 定量测定化学反应速率 | B. | 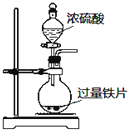 完成铁片与浓硫酸的反应 | ||
| C. |  从食盐水中提取NaCl | D. | 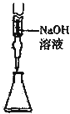 量取15.00mLNaOH |
16.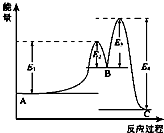 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 加入催化剂会改变反应的焓变 | ||
| C. | 三种化合物中C最稳定 | D. | 整个反应中△H=E1-E4 |
13.下列物质不能代替H2O2将I-氧化成碘单质的是( )
| A. | 酸性KMnO4溶液 | B. | 新制氯水 | C. | 稀硫酸 | D. | 过氧化钠 |
11.在硫跟金属的反应中,硫比较容易( )
| A. | 得到电子,显还原性 | B. | 失去电子,显还原性 | ||
| C. | 得到电子,显氧化性 | D. | 失去电子,显氧化性 |

 ,反应类型为酯化反应;
,反应类型为酯化反应; ,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH;
,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH;