题目内容
SO2+Cl2+2H2O═H2SO4+2HCl
(1)在化学方程式上标出电子转移的方向和数目
(2)在该反应中,氧化剂是 ,还原剂是 ,(填化学式);氧化性:Cl2 H2SO4,还原性:HCl SO2,(填“>”或“<”)
(1)在化学方程式上标出电子转移的方向和数目
(2)在该反应中,氧化剂是
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,得电子的反应物是氧化剂、失电子的反应物是还原剂,氧化剂被还原、还原剂被氧化,还原剂对应的产物是氧化产物.
解答:
解:(1)该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,转移电子数是2,转移电子数目和方向为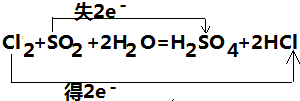 ,故答案为:
,故答案为: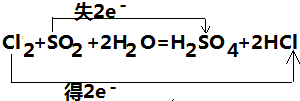 ;
;
(2)Cl元素的化合价降低,所以Cl2是氧化剂,S元素的化合价升高,则SO2是还原剂,由氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性可知,氧化性为Cl2>H2SO4,还原性为HCl<SO2,故答案为:Cl2;SO2;>;<.
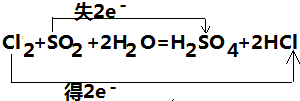 ,故答案为:
,故答案为: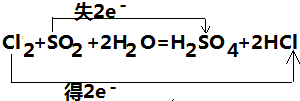 ;
;(2)Cl元素的化合价降低,所以Cl2是氧化剂,S元素的化合价升高,则SO2是还原剂,由氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性可知,氧化性为Cl2>H2SO4,还原性为HCl<SO2,故答案为:Cl2;SO2;>;<.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及发生的反应为解答的关键,侧重氧化还原反应基本概念的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
某分子式为C10H20O2的酯,在一定条件下可发生如图的转化过程:则符合上述条件的酯的结构可有( )


| A、2种 | B、4种 | C、6种 | D、8种 |
向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
| A、NaBr Na2S04 |
| B、NaCl NaI Na2S04 |
| C、NaCl NaBr Na2S04 |
| D、NaCl Na2S03 |





 (1)已知298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.3kJ.写出该反应的热化学方程式:
(1)已知298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.3kJ.写出该反应的热化学方程式: