题目内容
某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜.活动过程如下: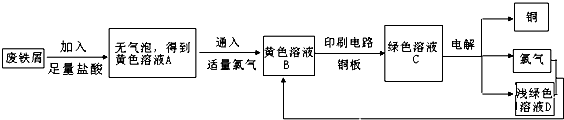
(1)写出废铁屑与盐酸反应的离子方程式:
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | ||
| ② | 检验绿色溶液C中是否含有Fe3+ |
(4)采用排液法收集氯气,该液体是
分析:(1)废铁屑的成分为氧化铁和铁,写出氧化铁与盐酸、铁与铁离子反应的离子方程式;
(2)在A的溶液中滴入酸性KMnO4溶液,根据KMnO4溶液颜色变化,说明是否含有亚铁离子;在C溶液中加入KSCN溶液,根据溶液是否变为红色,判断是否含有铁离子;
(3)根据电解回收Cu,溶液中铜离子发生还原反应判断;
(4)根据Cl2在饱和食盐水中溶解度较小完成本题.
(2)在A的溶液中滴入酸性KMnO4溶液,根据KMnO4溶液颜色变化,说明是否含有亚铁离子;在C溶液中加入KSCN溶液,根据溶液是否变为红色,判断是否含有铁离子;
(3)根据电解回收Cu,溶液中铜离子发生还原反应判断;
(4)根据Cl2在饱和食盐水中溶解度较小完成本题.
解答:解:(1)废铁屑由氧化铁和铁组成,氧化铁与稀盐酸反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;铁与铁离子反应生成了亚铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;
(2)在A的溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则,不含亚铁离子;
在C在溶液中加入KSCN溶液,溶液变为红色,说明含有铁离子,否则,不含铁离子,
故答案为:
;
(3)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故纯Cu应作阴极,
故答案为:纯铜;
(4)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水收集氯气,
故答案为:饱和食盐水.
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;
(2)在A的溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则,不含亚铁离子;
在C在溶液中加入KSCN溶液,溶液变为红色,说明含有铁离子,否则,不含铁离子,
故答案为:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 | 溶液出现血红色,则绿色溶液C仍有Fe3+ |
(3)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故纯Cu应作阴极,
故答案为:纯铜;
(4)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水收集氯气,
故答案为:饱和食盐水.
点评:本题考查元素铁和铜的性质,题目难度中等,试题以流程图的形式展示,涉及离子方程式的书写、Fe2+和Fe3+的检验、电解精炼铜以及氯气的收集等知识点,充分培养了学生的分析、理解能力.

练习册系列答案
相关题目



