题目内容
13.已知用氯酸钾制取氧气(1)写出化学方程式并标出电子转移的方向和数目.
(2)该反应,氧化剂KClO3,还原剂KClO3,氧化产物KCl,还原产物O2(填物质的化学式)
(3)已知1mol氯酸钾完全分解,可在标准状况下得到11.2L氧气.
分析 氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$KCl+3O2↑,反应中Cl元素化合价由+5价降低到-1价,O元素化合价由-2价升高到0价,以此确定电子转移的方向可数目,结合氧化还原反应基本概念及方程式中的物质的量关系解答.
解答 解:(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$KCl+3O2↑,反应中Cl元素化合价由+5价降低到-1价,O元素化合价由-2价升高到0价,由化合价变化可知,电子转移方向和数目可表示为 ,故答案为:
,故答案为: ;
;
(2)由元素的化合价变化可知,氧化剂、还原剂均为KClO3,Cl得到电子被还原,对应还原产物为KCl,O失去电子被氧化,对应氧化产物为O2,
故答案为:KClO3;KClO3;KCl;O2;
(3)由反应可知,2mol氯酸钾完全分解生成1mol气体,则1mol氯酸钾完全分解,可在标准状况下得到氧气为0.5mol×22.4L/mol=11.2L,故答案为:11.2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的分析及转移电子,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
3.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )
| A. | X:3s23P1 Y:3s23P5 | B. | X:2s22P3Y:2s22P4 | ||
| C. | X:3s23P1 Y:3s23P3 | D. | X:3s2Y:2s22P3 |
4.下列物质露置在空气中,成分不会发生变化的是( )
| A. | Na2O2 | B. | FeCl2 | C. | 漂白粉 | D. | Na2CO3 |
1.下列与化学反应能量变化相关的叙述不正确的是( )
| A. | 化学反应是旧键断裂和新键形成的过程 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
8.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| B. | 标准状况下,22.4LCl2和H2混合气体原子数为2NA | |
| C. | 0.1mol AlCl3完全转化为氢氧化铝胶体,会生成0.1NA个胶粒 | |
| D. | 常温常压下,100g 40%NaOH水溶液含氧原子总数为NA |
18.下列各组离子在指定溶液中,能大量共存的是( )
①无色溶液中:K+、Cl-、Na+、SO42-
②使pH=11的溶液中:Na+、AlO2-、K+、CO32-
③水电离的c(H+)=10-12mo1/L的溶液中:Cl-、HCO3-、NH4+、SO32-
④加Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、SO32-
⑤酸性溶液中:Fe2+、Ag+、NO3-、I-.
①无色溶液中:K+、Cl-、Na+、SO42-
②使pH=11的溶液中:Na+、AlO2-、K+、CO32-
③水电离的c(H+)=10-12mo1/L的溶液中:Cl-、HCO3-、NH4+、SO32-
④加Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、SO32-
⑤酸性溶液中:Fe2+、Ag+、NO3-、I-.
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ①② | D. | ①②③④ |
5.以下物质间的转化不能通过一步反应实现的是( )
| A. | HClO→O2 | B. | SiO2→H2SiO3 | C. | CO2→CaCO3 | D. | Cu→CuSO4 |
2.下列有关自然界中氮循环(如图)的说法不正确的是( )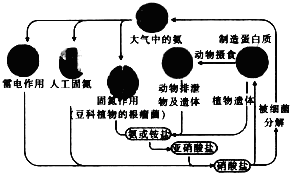

| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
7.我国科学家屠呦呦因发明抗疟新药青蒿素(分子式:C15H22O5)荣获2015年诺贝尔医学奖.青蒿素属于( )
| A. | 混合物 | B. | 有机物 | C. | 氧化物 | D. | 单质 |