题目内容
7.下列关于离子化合物的叙述不正确的是( )| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 有些离子化合物可能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
B.离子化合物中阳离子可能不是金属离子;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
D.溶于水可以导电的化合物可能是离子化合物也可能是共价化合物.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,所以离子化合物中都含有离子键,故A正确;
B.离子化合物中阳离子可能不是金属离子,如铵盐,故B错误;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH等,故C正确;
D.溶于水可以导电的化合物可能是离子化合物也可能是共价化合物,如硫酸等共价化合物,故D错误;
故选BD.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,明确物质构成微粒及微粒之间存在作用力是解本题关键,注意规律中的特殊现象,易错选项是B.

练习册系列答案
相关题目
17.在下列物质间相互变化中,需要加入氧化剂才能实现的是( )
| A. | H2SO4→MgSO4 | B. | NaCl→Cl2 | C. | CuSO4→Cu | D. | HClO→Cl2 |
15.下列实验方案合理的是( )
| A. | 用溴水或酸性KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 向酒精中加入足量生石灰检验酒精中是否含有少量水 | |
| C. | 在盛有2mL无水乙醇的试管中放入绕成螺旋状的光洁铜丝,加热可制得乙醛 | |
| D. | 将裂解气通入到酸性KMnO4溶液中来证明裂解气中是否有乙烯 |
2.下列说法正确的是( )
| A. | CHCl3是三角锥形 | |
| B. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 | |
| C. | AB2是V形,其A可能为sp2杂化 | |
| D. | NH4+是平面四边形结构 |
19.下列物质中所有原子均满足最外层8电子稳定结构的化合物是( )
| A. | PCl5 | B. | P4 | C. | CCl4 | D. | NH3 |
16.已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
17. 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)滤渣a的主要成分的化学式是SiO2;操作X用到的玻璃仪器有烧杯、玻璃棒、和漏斗.
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).

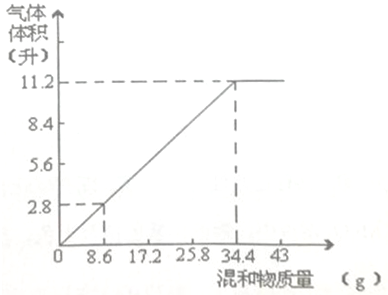 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.