题目内容
2.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.反应后溶液中的溶质为等浓度的醋酸、醋酸钠和NaCl,混合液显示酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒可得:c(CH3COO-)>c(Cl-)>c(CH3COOH);
B.二者恰好反应生成碳酸钠,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-);
C.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断;
D.二者恰好反应生成醋酸钠,根据醋酸钠溶液中的质子守恒判断.
解答 解:A.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,反应后溶液中的溶质为等浓度的醋酸、醋酸钠和NaCl,混合液显示酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒c(CH3COO-)+c(CH3COOH)=2c(Cl-)可得:c(CH3COO-)>c(Cl-)>c(CH3COOH),则溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故A正确;
B.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,恰好反应生成碳酸钠,碳酸根离子部分水解,溶液显示碱性,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),则溶液中正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故B错误;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液一定满足电荷守恒:c(H+)+c(Cl-)=c(NH4+)+c(OH-),故C错误;
D.0.1mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,二者恰好反应生成醋酸钠,根据醋酸钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选A.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,明确混合液中溶质组成及电荷守恒、物料守恒、质子守恒的含义为解答关键,注意掌握盐的水解原理及判断离子浓度大小常用方法

| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| A. | 在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化 | |
| B. | 溶液中四种离子之间有可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,则溶液中溶质一定是CH3COONa和CH3COOH |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液、水 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |

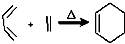 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题: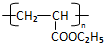 .
.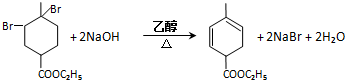 .
. 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为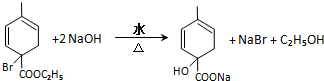 .
. .
.
 .
. 一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.