��Ŀ����
����Ŀ��2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�
2CO2��g�� + 6H2��g��![]() CH3OCH3��g�� + 3H2O��g�� ��H��0��
CH3OCH3��g�� + 3H2O��g�� ��H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ ��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬�������� ��
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v(CO2)�Uv(H2)=1�U3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO(g) + 2CO (g)![]() 2CO2 (g) + N2 (g)�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
2CO2 (g) + N2 (g)�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
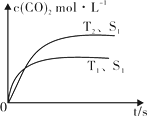
�� �÷�Ӧ����H 0��ѡ��������������������
�����������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1��S2����ͼ�л���c(CO2)��T2��S2�����´ﵽƽ������еı仯���ߡ�
��3����֪��CO��g�� + 2H2��g��![]() CH3OH��g����H = ��a kJmol-1��
CH3OH��g����H = ��a kJmol-1��
�����ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ����� | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250����ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO)=0.4 mol��L��1��c(H2)=0.4 mol��L��1��c(CH3OH)=0.8 mol��L��1, ���ʱv�� v������������������������=������
��ij�¶��£�������̶���2L���ܱ������н�1 mol CO��2 mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ��(P��/Pǰ) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��ǰ15���ӣ���������ʾ��ƽ����ѧ��Ӧ����Ϊ ���ﵽƽ��ʱCO��ת����Ϊ ��
���𰸡���1��![]() BD
BD
��2���� 
��3���� 0.02mol/(L min) 45��
��������
�����������1������ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ������ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽΪ![]() ��
��
��A�����ڸ÷�Ӧ���������㶨���ܱ������ڽ��еģ�������������䣬�������κ�ʱ�̶������������ܶȲ��䣬�ʲ�����Ϊ�ж�ƽ��ı�־��A���� B����λʱ��������2molCO2���ͻ����1mol�����ѣ���ͬʱ����1mol�����ѣ�˵�����ʵ������䣬���ʵ�Ũ�Ȳ��䣬���Է�Ӧ�ﵽƽ��״̬��B��ȷ��C�����κ�ʱ�̶�����v(CO2)�Uv(H2)=1�U3�����Բ����жϷ�Ӧ�Ƿ���ƽ��״̬��C����D����Ӧ���������㶨�������ڽ��еģ����÷�Ӧ�Ƿ�Ӧǰ�������������ȵķ�Ӧ��������������ѹǿ���ֲ��䣬����������ʵ������䣬��Ӧ����ƽ��״̬��D��ȷ����BD��
��2���ٴ������ܸı�ƽ��״̬���¶ȸߵ���ƽ���ʱ���٣���T1��T2���¶ȸ�CO2��ƽ��Ũ�ȼ�С����˵�������¶�ƽ�����淴Ӧ������У���������Ӧ�Ƿ��ȷ�Ӧ������H��0��
�ڴ����ı����S1��S2����T1��S2�����´ﵽƽ�����õ�ʱ���T1��S1Ҫ�������¶���ͬ����״̬��T1��S1��ͬ����ͼ��Ϊ�� ��
��
(3������250������ѧƽ�ⳣ����2.041�����ڴ�ʱ��Qc= c(CH3OH)/ (c(CO) c2(H2))=0.8 mol/L��[0.4 mol/L��(0.4 mol/L)2]=12.5��2.041,˵����Ӧ������У���v����v������������㶨���ܱ������ڽ��еķ�Ӧ�������ѹǿ֮�ȵ�����������ʵ����ıȡ�����ƽ��ʱ��ѹǿ�ǿ�ʼ��0.70������Ӧ��С�����ʵ�����3mol��0.30=0.90mol�����ݷ���ʽCO(g) + 2H2(g) ![]() CH3OH(g)��֪ÿ��1mol��CO������Ӧ����Ӧ����������ʵ��������2mol��������������ʵ�����С0.90mol�����Է�Ӧ��CO�����ʵ�����0.90mol��2=0.45mol�����CO��ת������(0.45mol��1mol) ��100%��45%��
CH3OH(g)��֪ÿ��1mol��CO������Ӧ����Ӧ����������ʵ��������2mol��������������ʵ�����С0.90mol�����Է�Ӧ��CO�����ʵ�����0.90mol��2=0.45mol�����CO��ת������(0.45mol��1mol) ��100%��45%��

����Ŀ��
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________������ţ�������������Һ�����õ��IJ���������______________�����������ƣ���
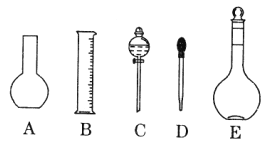
��2������ƿ�����������6���е�_________________������ţ�
�� �¶� ��Ũ�� ������ ��ѹǿ ���̶��� ����ʽ���ʽ
��3������ƿ��_________������ţ���
A������һ�����ȷŨ�ȵı���Һ |
B��������Һ |
C����������ƿ������µ����������Һ�� |
D��ȷϡ��ijһŨ�ȵ���Һ |
E�����������ܽ��������
��4�����ݼ�����������ƽ��ȡNaOH������Ϊ__________g��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84 g/cm3��Ũ��������Ϊ��__________mL������������һλС�����������ƹ����У����в��������������ƫ�ߵ���____________������ţ���
�� δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж���
�� ����ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
�� ����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶���
�� ����ʱ�����ӿ̶���
