题目内容
3.一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.下列关于该反应的说法错误的是( )| A. | 增大N2浓度可以增大反应速率 | |
| B. | 增大H2浓度可以使N2转化率达到100% | |
| C. | 升高温度可以加快反应速率 | |
| D. | 高压条件可以加快反应速率 |
分析 A、增大反应物浓度可以增大反应速率;
B、反应是可逆反应不能进行彻底;
C、升温,正逆反应速率都增大;
D、对于有气体参加的反应,增大压强反应速率增大,正逆反应速率都增大;
解答 解:A.增大反应物浓度可以增大反应速率,所以增大N2浓度可以增大反应速率,故A正确;
B、反应为可逆反应,反应物不能完全转化,所以增大H2浓度不可以使N2转化率达到100%,故B错误;
C、升高温度,化学反应速率加快,故C正确;
D、对于有气体参加的反应,增大压强,化学反应速率加快,故D正确.
故选B.
点评 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握原理应用是关键,题目较简单.

练习册系列答案
相关题目
13.有关下列反应的说法中,正确的是( )
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
11.用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL.需NaOH溶液体积最大的是( )
| A. | 盐酸 | B. | 硝酸 | C. | 醋酸 | D. | 高氯酸 |
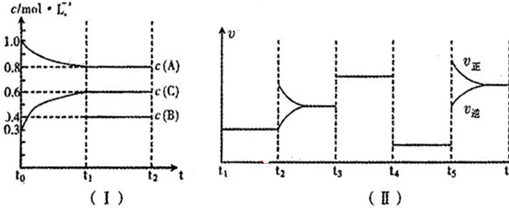
8.(1)向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图I所示,其中t0~t1阶段c(B)画出.图Ⅱ为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接);
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g) 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol
(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.

请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
15.室温下,pH=13的碱溶液V1mL与pH=2的硫酸溶液V2mL混合,得混合液pH=11,则V1:V2为( )
| A. | V1:V2≥11:1 | B. | V1:V2≥9:1 | C. | V1:V2≤11:1 | D. | V1:V2≤1:9 |
12.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、C1-、HCO3- | |
| B. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| C. | 能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、A13+、SO42- |
13.A气体的水溶液呈酸性,若将A通入酸性的KMnO4溶液中,则紫红色褪色;若将A通入Br2水中,则Br2褪色并出现浑浊,则A气体是( )
| A. | Cl2 | B. | SO2 | C. | H2S | D. | CO2 |