题目内容
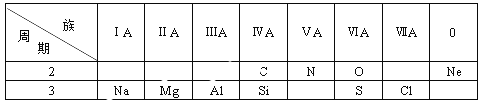
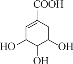
【题目】在元素周期表中的某些元素之间存在着特殊的“对角线关系”,例如:![]() 、
、![]() 、
、![]() 相似等,下列说法不正确的是
相似等,下列说法不正确的是![]()
A.氢氧化铍是两性氢氧化物
B.B、Si的电负性数值相似
C.Li和Mg的原子半径相近,且核外电子排布相近
D.Li在![]() 中燃烧能生成
中燃烧能生成![]()
【答案】C
【解析】
![]() 氢氧化铍与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,可推知氢氧化铍是两性氢氧化物,故A正确;
氢氧化铍与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,可推知氢氧化铍是两性氢氧化物,故A正确;
B.B、Si处于对角线,性质相似,二者电负性数值相近,故B正确;
C.![]() 处于对角线,性质相似,但不能判断原子半径,且Mg的原子半径大于Li,也不能判断核外电子排布,故C错误;
处于对角线,性质相似,但不能判断原子半径,且Mg的原子半径大于Li,也不能判断核外电子排布,故C错误;
D.Mg在氮气中燃烧生成离子化合物氮化镁,Li、Mg性质相似,Li在![]() 中燃烧能生成离子化合物
中燃烧能生成离子化合物![]() ,故D正确;
,故D正确;
故选C。

【题目】电离能是衡量元素失电子能力的重要依据,随着元素核电荷数的递增,电离能值呈现周期性变化规律。根据所学知识,回答下列问题。
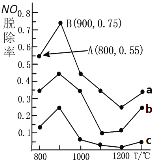
![]() 第一电离能指的是______。
第一电离能指的是______。
![]() 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能![]() 随原子序数变化关系
随原子序数变化关系![]() 其中12号至17号元素的有关数据缺失
其中12号至17号元素的有关数据缺失![]() 。
。
![]() 根据图示变化规律,可推测S的第一电离能的大小
根据图示变化规律,可推测S的第一电离能的大小![]() 最小
最小![]() 范围为______
范围为______![]() ______
______![]() 填元素符号
填元素符号![]() 。
。
![]() 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能![]() 变化规律是______。
变化规律是______。
![]() 图中第一电离能最小的元素在周期表中的位置______。
图中第一电离能最小的元素在周期表中的位置______。
![]() 根据对角线规则铍元素最高价氧化物的水化物应该具有______。
根据对角线规则铍元素最高价氧化物的水化物应该具有______。
![]() 用In表示元素的第n电离能,则图中的a、b、c分别代表______。
用In表示元素的第n电离能,则图中的a、b、c分别代表______。

A.a为![]() 、b为
、b为![]() 、c为
、c为![]()
B.a为![]() 、b为
、b为![]() 、c为
、c为![]()
C.a为![]() 、b为
、b为![]() 、c为
、c为![]() D.a为
D.a为![]() 、b为
、b为![]() 、c为
、c为![]()
![]() 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能 |
|
|
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能![]() 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能![]() 却大于锌的第二电离能,其主要原因是______。
却大于锌的第二电离能,其主要原因是______。
![]() 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能![]() ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能![]() ,部分元素或离子的电子亲和能数据如下表所示:
,部分元素或离子的电子亲和能数据如下表所示:
元素 | Cl | Br | I | O |
|
电子亲和能 | 349 | 343 | 295 | 141 |
|
![]() 下列说法中错误的是______。
下列说法中错误的是______。
A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为![]() 时放出141kJ的能量
时放出141kJ的能量
C.氧元素的第二电子亲和能是![]()
D.基态的气态氧原子得到两个电子成为![]() 需要吸收能量
需要吸收能量
![]() 图中数据显示,同主族元素
图中数据显示,同主族元素![]() 从上到下依次减小,其原因是_____。
从上到下依次减小,其原因是_____。