题目内容
19.向AlCl3、FeCl2、FeCl3的混和溶液中逐滴加入NaOH溶液,达到除去Fe2+、Fe3+的目的,以下推断正确的是( )已知:
①Fe(OH)2为絮状,不易从溶液中除去;
②Fe(OH)3、Fe(OH)2、Al(OH)3沉淀的生成与溶解的pH列于表.
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.7 | 3.7 | - | - |
| Fe(OH)2 | 7.6 | 9.6 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 为了达到目的,首先应在溶液中加入双氧水或氯水将Fe2+氧化为Fe3+ | |
| B. | 加入NaOH溶液,调节溶液的pH在9.6以上就能达到实验目的 | |
| C. | 本实验产生沉淀的顺序为Fe(OH)3→Al(OH)3→Fe(OH)2 | |
| D. | 实验中生成的Fe(OH)2迅速变为灰绿色,最终变为红褐色沉淀 |
分析 向AlCl3、FeCl2、FeCl3的混和溶液中逐滴加入NaOH溶液,达到除去Fe2+、Fe3+的目的,实验目的是除去Al3+中的Fe2+和Fe3+,根据三种离子形成氢氧化物沉淀时的pH情况分析,形成Fe(OH)2沉淀的pH较高,一般采用将Fe2+氧化为Fe3+,再形成Fe(OH)3沉淀除去Fe2+和Fe3+的方法,据此分析.
解答 解:A.根据三种离子形成氢氧化物沉淀时的pH情况分析,形成Fe(OH)2沉淀的pH较高,一般采用将Fe2+氧化为Fe3+,再形成Fe(OH)3沉淀除去Fe2+和Fe3+的方法,因此为了达到目的,首先应在溶液中加入双氧水或氯水将Fe2+氧化为Fe3+,故A正确;
B.实验目的是除去Fe2+、Fe3+的目的,同时要求保留Al3+,加入NaOH溶液,调节溶液的pH在9.6以上,此时Al3+会被转化为[Al(OH)4]-,不符合除杂目的,故B错误;
C.实验中将Fe2+转化为Fe3+,Fe(OH)3开始沉淀时Al3+还没有形成Al(OH)3沉淀,故C错误;
D.实验中将Fe2+转化为Fe3+,调控pH使Fe3+形成Fe(OH)3沉淀从而除杂,不再形成Fe(OH)2沉淀,故D错误.
故选A.
点评 本题考查除杂方法,对于形成氢氧化物沉淀法除去Fe2+和Fe3+时,通常用氧化剂氧化Fe2+生成Fe3+,然后沉淀,题目难度中等.

练习册系列答案
相关题目
7.甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体的数目为( )
| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
14.对如图所示的铜锌原电池,说法正确的是( )


| A. | 铜极是负极 | B. | 铜片上有气泡产生 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后溶液的质量减轻 |
11.下列指定反应的离子方程式正确的是( )
| A. | 向 H2O中通入NO2:3NO2+H2O═H++NO3-+2NO | |
| B. | 氯气溶于水:Cl2+H2O2═H++Cl-+ClO- | |
| C. | 用饱和纯減溶液洗涤试管中残留的苯酚:CO32-+2C6H5OH═2C6H5O-+CO2↑+H2O | |
| D. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ |
7.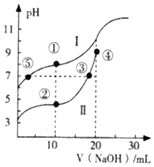 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |

 .
.