题目内容
| |||||||||||
答案:
解析:
解析:
(1) |
Na2CO3 CuSO4,Na2SO4,CaCl2 NaCl(每空2分) |
(2) |
AgNO3,溶液产生白色沉淀,Clˉ+Ag+=AgCl↓(方程式2分,其余1分) |

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl混合而成,为检验它的成分做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解.则该固体混合物中( )
| A、肯定有Na2SO4 可能有CuSO4 | B、一定有NaCl 肯定没有Na2SO4 | C、一定有Na2CO3 可能有NaCl | D、可能有CaCl2 一定没有CuSO4 |

 可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下: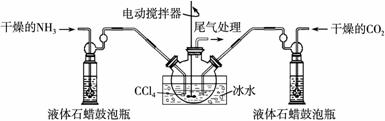
 浓硫酸的作用: 、 。
浓硫酸的作用: 、 。