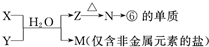
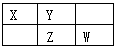
题目内容
如图为元素周期表的一部分,请针对给出的5种元素回答下列问题:

(1)元素①的原子结构示意图为:
 .
.
(2)第二周期标出的元素中最高价氧化物对应的水化物酸性较强的是
(3)请写出元素⑤的氢氧化物和稀盐酸反应的离子方程式

(1)元素①的原子结构示意图为:


(2)第二周期标出的元素中最高价氧化物对应的水化物酸性较强的是
N
N
(填元素符号);④⑤两种元素的离子氧化性较强的是Al3+
Al3+
(填离子符号).(3)请写出元素⑤的氢氧化物和稀盐酸反应的离子方程式
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.分析:由元素在周期表中的位置可知,①是H、②是C、③是N、④是Na、⑤是Al;
(1)H原子核外电子数是1,只有1个电子层;
(2)非金属性越强,最高价氧化物对应的水化物酸性越强;金属性越强,阳离子的氧化性越弱;
(3)氢氧化铝与盐酸反应生成氯化铝与水.
(1)H原子核外电子数是1,只有1个电子层;
(2)非金属性越强,最高价氧化物对应的水化物酸性越强;金属性越强,阳离子的氧化性越弱;
(3)氢氧化铝与盐酸反应生成氯化铝与水.
解答:解:由元素在周期表中的位置可知,①是H、②是C、③是N、④是Na、⑤是Al;
(1)H原子核外电子数是1,只有1个电子层,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)非金属性C<N,非金属性越强,最高价氧化物对应的水化物酸性越强,故HNO3酸性较强;
金属性Na>Al,金属性越强,阳离子的氧化性越弱,故氧化性Al3+>Na+,Al3+较强,
故答案为:N;Al3+;
(3)氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O.
(1)H原子核外电子数是1,只有1个电子层,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)非金属性C<N,非金属性越强,最高价氧化物对应的水化物酸性越强,故HNO3酸性较强;
金属性Na>Al,金属性越强,阳离子的氧化性越弱,故氧化性Al3+>Na+,Al3+较强,
故答案为:N;Al3+;
(3)氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O.
点评:本题考查元素周期表、常用化学用语书写、元素周期律等,比较基础,注意基础知识的掌握.

练习册系列答案
相关题目
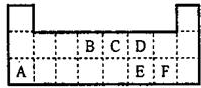 如图为元素周期表的一部分.表中所列的字母分别代表某一元素.
如图为元素周期表的一部分.表中所列的字母分别代表某一元素.

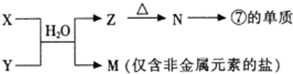
 如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的
如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的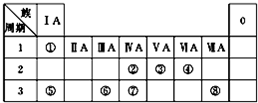 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: